
分析 (1)分析反应中各元素化合价变化,依据氧化还原反应得失电子守恒,原子个数守恒配平方程式;
(2)反应物中所含元素化合价升高的为还原剂,对应氧化产物,所含元素化合价降低的 反应物为氧化剂,对应还原产物;依据K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O,可知生成3mol氯气转移6mol电子,被氧化的氯化氢物质的量为6mol;
(3)反应中H2S中S氧化化合价升高,SO2中S元素化合价降低,氧化产物为2mol,还原产物为1mol,此时氧化产物比还原产物多32g,据方程式计算.
解答 解:(1)K2Cr2O7+HCl(浓)-KCl+CrCl3+Cl2↑+H2O,K2Cr2O7中+6价Cr化合价降为CrCl3中+3价,反应1molK2Cr2O7,得到6mol电子,HCl中-1价的Cl化合价升高为Cl2中的0价,生成1molCl2失去2mol电子,依据得失电子守恒可知:CrCl3系数为2,Cl2系数为3,然后根据反应前后各种原子个数相等配平,故方程式K2Cr2O7+14HC1=2KC1+2CrCl3+7H2O+3Cl2↑,
故答案为:1;14;2;2;7;3;
(2)反应中K2Cr2O7中+6价Cr化合价降为CrCl3中+3价,所以K2Cr2O7为氧化剂,CrCl3为还原产物;HCl中-1价的Cl化合价升高为Cl2中的0价,所以HCl为还原剂,Cl2为氧化产物;
依据 ~6mole-
~6mole-
2 6
1 3 故电子转移3mol
从反应中得14HCl中有6HCl价态发生变化,还有8个未发生变化,故作还原剂的为6mol,氧化剂K2Cr2O7为1mol,故氧化剂与还原剂的物质的量之比为1:6;
故答案为:HCl;CrCl3;3;1:6;
(3)反应2H2S+SO2═3S↓+2H2O中,生成3molS,氧化产物为2mol,还原产物为1mol,此时氧化产物比还原产物多32g,同时会生成水2mol,若氧化产物比还原产物多1.6g,同时会生成水0.1mol,质量是1.8g;故答案为:1.8.
点评 本题考查了氧化还原反应,涉及氧化还原反应基本概念,方程式配平,双线桥表示,明确反应中各元素化合价变化及相关概念是解题关键,题目难度中等.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
| A. | 199F- | B. | 1910Ne | C. | 2910F | D. | 2919K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
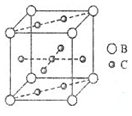 A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q
A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q .
.| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子组 | 加入试剂 | 离子方程式 | |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | SO42-+2NH4++Ba2++2OH-=BaSO4↓+2NH3•5H2O |
| B | Mg2+、HCO3-、Cl-、 | 过量NaOH溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe3+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光束穿过胶体时形成一条光亮的“通路” | |
| B. | 胶体粒子直径大小在1~100nm之间 | |
| C. | 胶体粒子可以透过滤纸 | |
| D. | 胶体粒子带有一定数目的电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 的Na2SO4溶液中含有4 NA个Na+ | |
| B. | 将含有0.1 mol FeCl3的饱和溶液逐滴滴入足量沸水中,得到Fe(OH)3胶体数目为0.1 NA | |
| C. | 在标准状况下,11.2 L氖气中含有NA个氖原子 | |
| D. | 7.8 g Na2O2中阴离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 | 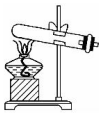 |  |  |
| 混合反应物 | 生成乙酸乙酯 | 收集乙酸乙酯 | 分离乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com