
 (1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池:用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气.写出负极的电极反应式
(1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池:用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气.写出负极的电极反应式
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

2- 7 |
2- 7 |
2- 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | 0.01mol?L-1 酸性KMnO4溶液 | 0.1mol?L-1 H2C2O4溶液 | 水 | 1mol?L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 1mL | 0 | 20 | 320 | ||
| Ⅲ | 0 | 50 | 30 | |||
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-41.2kJ?mol-1 |
| B、+165.0kJ?mol-1 |
| C、-288.6kJ?mol-1 |
| D、+453.6kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
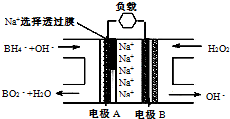 直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是( )
直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是( )| A、电极B材料中包含MnO2层,MnO2可起催化作用 |
| B、电池负极区的电极反应为:BH4-+8OH-+8e-=BO2-+6H2O |
| C、放电过程中,Na+ 从正极区向负极区迁移 |
| D、在电池反应中,每消耗1L 6 mol/LH2O2溶液,理论上流过电路中的电子为6NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤干馏可以得到甲烷、苯和氨等重要化工原料 |
| B、石油的催化裂化是为了提高汽油等轻质燃油的产量和质量 |
| C、油脂都不能使溴的四氯化碳溶液褪色 |
| D、粮食酿的酒在一定条件下密封保存一定时间会更香醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com