
| A. | Na2SO4 | B. | FeCl3 | C. | NaHCO3 | D. | CH3COOH |
分析 盐中弱离子在水溶液里水解,导致溶液中氢离子和氢氧根离子浓度大小不等,从而使溶液呈现酸碱性,根据“谁强谁显性、谁弱谁水解、强强显中性”来分析解答.
解答 解:A.Na2SO4是强酸强碱盐,没有能水解的离子,溶液中氢离子和氢氧根离子浓度相等,则溶液呈中性,故A正确;
B.FeCl3是强酸弱碱盐,铵根离子水解而使其溶液呈酸性,故B错误;
C.NaHCO3是强碱弱酸盐,碳酸根离子水解而使其溶液呈碱性,故C错误;
D.CH3COOH为弱酸,溶液呈酸性,故D错误.
故选A.
点评 本题考查了盐溶液的酸碱性判断,为高频考点,侧重于学生的分析能力的考查,根据盐的类型结合“谁强谁显性、谁弱谁水解、强强显中性”来分析解答,注意中学阶段不考虑弱酸弱碱盐溶液酸碱性的判断,难度不大,


科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,1mol氦气含有的原子数为NA | |
| B. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| C. | 常温常压下,氧气和臭氧(O3)的混合物32g中含有NA个氧原子 | |
| D. | 物质的量浓度为1 mol•L-1的K2SO4溶液中,含2NA个K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
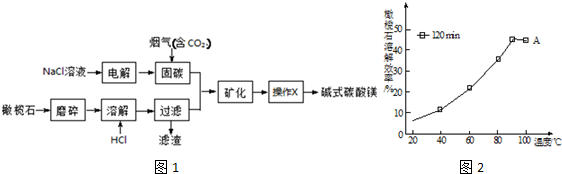
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
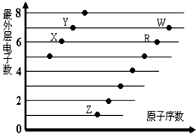
| A. | X与Z两种元素形成的化合物一定是离子化合物,有且只有离子键 | |
| B. | RX2、WX2、Z2X2都能使品红溶液褪色,且褪色原理相同 | |
| C. | R、W所形成的氧化物的水化物的酸性强弱为W>R | |
| D. | X、Y、R、W四种元素形成的气体氢化物中最稳定的是 Y 的气态氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
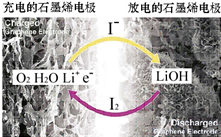 科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )
科学家开发出一种新型锂-氧电池,其能量密度极高,效率达到90%以上,电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$2I2+4LiOH对于该电池的下列说法不正确的是( )| A. | 充电时阴极反应为LiOH+e-═Li+OH | |
| B. | 充电时Li+从阳极区移向阴极区 | |
| C. | 放电时正极反应为O2+2H2O+4Li++4e-═4LiOH | |
| D. | 放电时负极上I- 被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类都能够发生水解 | |
| B. | 蛋白质的水解产物都含有羧基和羟基 | |
| C. | 油脂碱性水解可以制取肥皂和甘油 | |
| D. | 它们都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA溶液中加入NaA固体后,$\frac{c(HA)c(O{H}^{-})}{c({A}^{-})}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | 常温下,0.1mol/LNaA溶液水解常数为10-9 | |
| D. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)═c(A-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
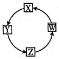 X、Y、Z、W四种物质间的转化关系如图所示,下列转化关系中不能一步实现的是
X、Y、Z、W四种物质间的转化关系如图所示,下列转化关系中不能一步实现的是| 选项 | X | Y | Z | W |
| A | Na | Na2O2 | NaOH | NaCl |
| B | H2S | SO2 | SO3 | H2SO4 |
| C | Fe | FeCl3 | Fe(OH)3 | Fe2O3 |
| D | AlCl3 | NaAlO2 | Al(OH)3 | Al |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
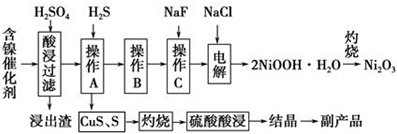
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com