

分析 (1)Cu是29号元素,其原子核外有29个电子,根据构造原理书写Cu原子核外电子排布式;
(2)①共价单键为σ键、共价双键之间的化学键为σ键和π键;含有孤电子对和含有空轨道的原子之间存在配位键;
②价层电子对个数为2的原子为sp杂化、价层电子对个数为3的原子为sp2杂化、价层电子对个数为4的原子为sp3杂化,根据价层电子对互斥理论判断原子杂化方式;
(3)先计算硝酸根离子之间N原子价层电子对个数,根据价层电子对互斥理论判断硝酸根离子空间构型;
含有氢键的物质熔沸点较高;
(4)利用均摊法确定化学式;根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)Cu是29号元素,其原子核外有29个电子,根据构造原理书写Cu原子核外电子排布式为[Ar]3d94s2,故答案为:[Ar]3d94s2;
(2)①共价单键为σ键、共价双键之间的化学键为σ键和π键,碳氮原子之间的化学键为σ键和π键;含有孤电子对和含有空轨道的原子之间存在配位键,Ni原子含有空轨道、N原子含有孤电子对,所以二者形成的化学键为配位键,
故答案为:σ键和π键;配位键;
②价层电子对个数为2的原子为sp杂化、价层电子对个数为3的原子为sp2杂化、价层电子对个数为4的原子为sp3杂化,根据图知,甲基上共价键个数是4,采用杂化sp3,碳氮原子中C原子价层电子对个数是3,采用杂化sp2,
故答案为:sp3和sp2;
(3)NO3-中N原子价层电子对个数=3+$\frac{5+1-3×2}{2}$=3且不含孤电子对,则空间构型是平面三角形,乙酸分子之间能形成氢键、乙醛分子之间不能形成氢键,含有氢键的物质熔沸点较高,所以乙酸熔沸点大于乙醛,故答案为:平面三角形;乙酸分子之间形成氢键而使其熔沸点较高;
(4)N原子个数=8×$\frac{1}{8}$=1、Cu原子个数=12×$\frac{1}{4}$=3,所以其化学式为Cu3N;
晶胞体积=(a×10-10)3cm3,密度=$\frac{\frac{M}{{N}_{A}}}{V}$=$\frac{\frac{64×3+14}{{N}_{A}}}{(a×1{0}^{-10})^{3}}$g•cm-3=$\frac{206}{(a×1{0}^{-10})^{3}{N}_{A}}$g.cm-3,
故答案为:Cu3N;$\frac{206}{(a×1{0}^{-10})^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、微粒空间构型判断、原子杂化方式判断等知识点,明确晶胞原理及计算方法是解本题关键,难点是晶胞计算.


科目:高中化学 来源: 题型:解答题
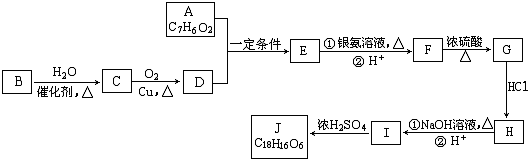
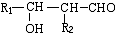
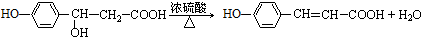 .
.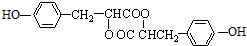 .
.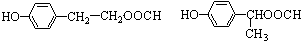 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓氨水加到盛有AgCl固体的试管中 | AgCl固体完全溶解 | 所得溶液中c(Ag+)•c(Cl-) ≤Ksp(AgCl) |
| B | 向FeI2溶液中通入少量的氯气,再向反应后的溶液中滴加KSCN溶液 | 溶液变为红色 | Cl2能将Fe2+氧化成Fe3+ |
| C | 向固体纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液 | 溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
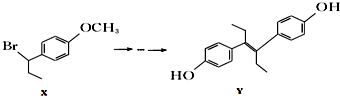
| A. | 化合物x中不含有手性碳原子 | |
| B. | 1mol化合物Y与浓溴水反应,最多消耗5mol Br2 | |
| C. | 在一定条件下化合物Y能发生加聚反应、缩聚反应 | |
| D. | 在氢氧化钠水溶液中加热,化合物X能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
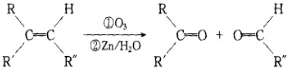
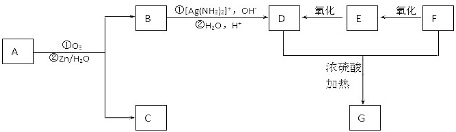
 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子间都以单链相连的链烃是烷烃 | |
| B. | 所有糖类物质都有甜味 | |
| C. | 油与脂肪都属于甘油酯 | |
| D. | 葡萄糖与果糖互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
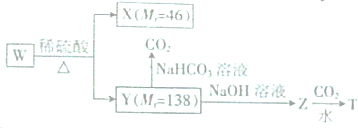
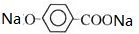 +CO2+H2O→
+CO2+H2O→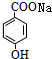 +NaHCO3.
+NaHCO3.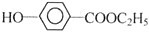
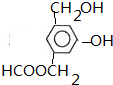 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
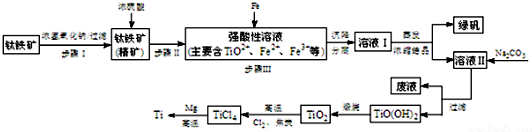
| pH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Ti(OH)2 |
| 开始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com