
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L-1) | c1 | c2 | 0.4 |
| A. | 若升高温度,反应的平衡常数减小,则正反应为吸热反应 | |
| B. | 反应5 min内,v(PCl3)=0.08 mol•L-1•min-1 | |
| C. | 当容器中为1.2 mol Cl2时,可逆反应达到平衡状态 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
分析 A、若升高温度,反应的平衡常数减小,平衡逆向移动,则正反应为放热反应;
B、根据v=$\frac{△c}{t}$求得PCl5的速率,利用速率之比等于计量数之比求得PCl3的速率;
C、平衡时△c(PCl5)=0.4mol/L,根据方程式可知△c(Cl2)=0.4mol/L,根据△n=△c×V计算△n(Cl2),进而计算平衡时Cl2的物质的量;
D、平衡后移走2.0mol PCl3和1.0mol Cl2,就相当于起始物质的量为原来的一半,由于容器体积不变,所以新平衡时压强减小,平衡逆向移动,PCl5的浓度小于原来的一半,据此判断.
解答 解:A、若升高温度,反应的平衡常数减小,平衡逆向移动,则正反应为放热反应,故A错误;
B、根据v=$\frac{△c}{t}$求得PCl5的速率为$\frac{0.4}{5}$mol•L-1•min-1=0.08mol•L-1•min-1,利用速率之比等于计量数之比求得PCl3的速率为0.08mol•L-1•min-1,故B正确;
C、平衡时△c(PCl5)=0.4mol/L,根据方程式可知△c(Cl2)=0.4mol/L,△n(Cl2)=0.4mol/L×2L=0.8mol,故平衡时Cl2的物质的量为1mol/L×2L-0.8mol=1.2mol,故C正确;
D、平衡后移走2.0mol PCl3和1.0mol Cl2,就相当于起始物质的量为原来的一半,由于容器体积不变,所以新平衡时压强减小,平衡逆向移动,PCl5的浓度小于原来的一半,故D正确;
故选A.
点评 本题考查化学平衡常数的应用、化学平衡的有关计算等,难度中等,注意D选项中构建平衡建立的途径.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol/L | B. | 0.3 mol/L | C. | 0.4 mol/L | D. | 0.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中碳原子不在一条直线上 | B. | 光照不能够发生取代反应 | ||
| C. | 是石油分馏的一种产品 | D. | 比丁烷更易液化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cd | B. | NiO(OH) | C. | Cd(OH)2 | D. | Ni(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A组 | B组 | C组 | D组 |
| 金刚石:3110℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1410℃ | Na:98℃ | HCl:-114℃ | KCl:776℃ |
| 硼晶体:2300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
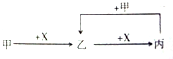
| A. | 甲为C,X为O2 | B. | 甲为Fe,X为Cl2 | ||
| C. | 甲为CO2,X为NaOH溶液 | D. | 甲为HCl,X为Na2CO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com