
| A. | HF、HCl、HBr、HI的沸点依次升高 | B. | HF、HCl、HBr、HI还原性依次增强 | ||
| C. | HF、HCl、HBr、HI稳定性依次增强 | D. | HF、HCl、HBr、HI酸性依次增强 |
分析 A.HF分子间含氢键,沸点最高;
B.非金属性越强,对应氢化物的还原性越弱;
C.非金属性越强,对应氢化物越稳定;
D.原子半径越大,共价键越易断裂,则氢化物的酸性越强.
解答 解:A.HF分子间含氢键,沸点最高,则HCl、HBr、HI、HF的沸点依次升高,故A错误;
B.非金属性F>Cl>Br>I,HF、HCl、HBr、HI还原性依次增强,故B正确;
C.非金属性F>Cl>Br>I,HF、HCl、HBr、HI稳定性依次减弱,故C错误;
D.原子半径I>Br>Cl>F,HF、HCl、HBr、HI酸性依次增强,故D正确;
故选BD.
点评 本题考查元素周期律和周期表的应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
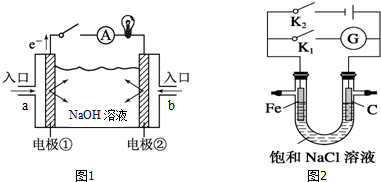
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
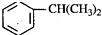 ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空: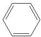 +
+ →
→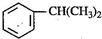 ,反应类型为加成反应.
,反应类型为加成反应.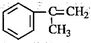 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法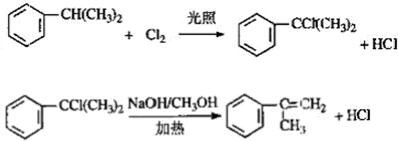 (用化学反应方程式表示).
(用化学反应方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
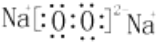
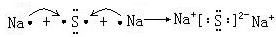
 、其最高价氧化物对应的水化物的化学式H3PO4.
、其最高价氧化物对应的水化物的化学式H3PO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| B. | ${\;}_{2}^{4}$He原子核内含有4个质子 | |
| C. | ${\;}_{2}^{3}$He原子核内含有3个中子 | |
| D. | ${\;}_{2}^{4}$He的最外层电子数为2,金属性较强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2为V形的极性分子 | B. | ClO3-的空间构型为三角锥形 | ||
| C. | SF6中有6对完全相同的成键电子对 | D. | PCl5和SO3均为非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0l mol•L-1•s-1 | B. | 0.002 mol•L-1•s-1 | ||
| C. | 0.06mol•L-•1s-1 | D. | 0.0025mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com