
| A、硫酸的摩尔质量是98 |
| B、1mol氧的质量等于16g |
| C、摩尔是一个基本物理量 |
| D、以克为单位时,12g12C所含的原子数为阿伏伽德罗常数 |


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:
| A、2NO2(g)?N2O4(g)△H<0 |
| B、3O2(g)?2O3(g)△H>0 |
| C、H2(g)+I2(g)?2HI(g)△H<0 |
| D、NH4HCO3(s)?NH3(g)+H2O(g)+CO2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| 化学键 | H-Cl | O=O | Cl=Cl | H-O |
| 键能/kJ.mol-1 | 431 | 498 | 243 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,Ph=12的NaOH溶液中含有OH-的数目为0.01NA |
| B、1L 0.25mol.L-1醋酸溶液中含CH3COOH分子数为0.25NA |
| C、7.8gNa2O2中阴阳离子总数为0.4NA |
| D、标准状况下,2.24L氧气与氮气的混合气体所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、该反应是氧化还原反应 |
| B、MnO2发生还原反应 |
| C、HCl是还原剂 |
| D、若生成7.1 g Cl2,则转移0.1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2的水解产物是NaOH和H2O2 |
| B、PCl3的水解产物是PH3和HClO |
| C、Mg3N2的水解产物是Mg(OH)2和NH3 |
| D、SiCl4的水解产物是H4SiO4与HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属元素的原子最外层电子数越少,则该元素的金属性越强 |
| B、同周期元素原子半径和离子半径从左到右均依次减小 |
| C、第三周期非金属氧化物对应水化物的酸性从左到右依次增强 |
| D、第ⅦA族元素气态氢化物的还原性从上到下依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硝基苯的结构简式: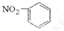 | ||
B、NH4Cl的电子式: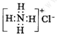 | ||
C、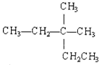 的名称为:3,3二甲基戍烷 的名称为:3,3二甲基戍烷 | ||
D、具有16个质子、16个种子和18个电子的微粒一定是
|
查看答案和解析>>
科目:高中化学 来源: 题型:
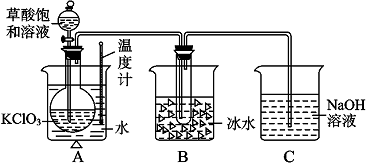
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入加入足量0.1mol?L-1 CH3COOH. | |
| 步骤2: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com