
| 选项 | X | Y | Z |
| ① | N2 | Mg | CO2 |
| ② | KOH溶液 | SiO2 | 氢氟酸 |
| ③ | O2 | N2 | H2 |
| ④ | 稀硝酸 | Fe | FeCl3溶液 |
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
分析 ①、常温下镁与氮气以及CO2均不反应;
②常温下二氧化硅与氢氧化钾溶液反应生成硅酸钾和水,与HF反应生成四氟化硅和水;
③常温下氮气与氢气以及氧气均不反应;
④常温下铁与氯化铁反应生成氯化亚铁,与稀硝酸反应生成硝酸铁、NO和水.
解答 解:①、常温下镁与氮气以及CO2均不反应,点燃时可以反应,故错误;
②常温下二氧化硅与氢氧化钾溶液反应生成硅酸钾和水,与HF反应生成四氟化硅和水,所以Y既能与X反应,又能与Z反应,故正确;
③常温下氮气与氢气要在高温高压催化剂存在的条件下反应,氮气与氧气在放电的条件下反应,常温下均不反应,故错误;
④常温下铁与氯化铁反应生成氯化亚铁,与稀硝酸反应生成硝酸铁、NO和水,所以Y既能与X反应,又能与Z反应,故正确;
故选D.
点评 本题考查元素化合物性质,难度不大,侧重对基础知识的巩固,需要学生熟练掌握元素化合物性质.


科目:高中化学 来源: 题型:选择题
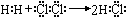 ;
;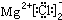 ,
,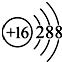
| A. | ①②③④⑤ | B. | ④⑤ | C. | ③④⑤ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
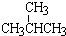 和
和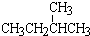 ; ②
; ②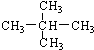 和
和 ; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).
; ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3).| 类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
| 组号 | ⑤⑥ | ①③ | ④⑧ | ②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0015 g•cm-3 | B. | 0.0012 g•cm-3 | C. | 0.0024 g•cm-3 | D. | 0.002 g•cm-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒(如图).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知氯化钴及其水合物会呈现不同颜色(如下),德国科学家发明了添加氯化钴的变色水泥,据此推测雨天变色水泥呈粉红色 | |
| B. | 已知铬酸根(黄色)和重铬酸根(橙色)离子间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O,若加水稀释,则溶液中所有离子浓度均减少 | |
| C. | 若反应2A(g)+B(s)?C(g)+3D(g)只有高温下才能自发进行,则该反应的△H>0 | |
| D. | 增大反应物的浓度,可使单位体积内活化分子数目增多,反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: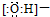 | B. | 硫原子的原子结构示意图: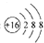 | ||
| C. | 乙烯分子的实验式:C2H4 | D. | 3,3一二甲基一1一戊烯的键线式: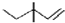 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 | |
| C. | 第③组反应中生成1mol Cl2,转移电子2mol | |
| D. | 第②组反应中Cl2与 FeBr2的物质的量之比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com