
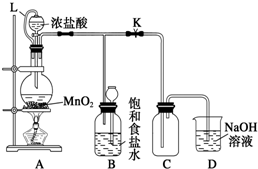
分析 (1)烧瓶内二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
(2)二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应;
(3)L将分液漏斗与圆底烧瓶连接,起到平衡压强作用;浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(5)浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气,依据氯气、氯化氢的水溶性、浓硫酸的吸水性进行除杂.
解答 解:(1)烧瓶内二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)盐酸具有挥发性,加热促进氯化氢的挥发,随着反应的进行,盐酸的浓度逐渐减小,二氧化锰只能与浓盐酸发生反应,与稀盐酸不反应;
故答案为:加热使HCl大量挥发;盐酸变稀后不再发生反应;
(3)L将分液漏斗与圆底烧瓶连接,起到平衡压强作用,便于液体顺利流下,故答案为:平衡气压,使浓盐酸顺利放出;
(4)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(5)浓盐酸易挥发,制备的氯气中含有氯化氢、水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,选择饱和食盐水除去氯化氢,浓硫酸具有吸水性能够干燥氯气,要得到干燥的氯气,应先除去氯化氢,再干燥,
故答案为:饱和食盐水;浓硫酸.
点评 本题考查了气体的制备,熟悉氯气的制备原理是解题关键,注意氯气的收集和除杂、尾气处理的方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | MO | B. | MO2 | C. | MO3 | D. | M2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是酸性氧化物,不与任何酸反应 | |
| B. | 因为CO2通入水玻璃中可制得硅酸,说明碳酸的酸性比硅酸酸性强 | |
| C. | SiO2是制造光导纤维的材料,SiO2晶体中,每个硅原子与两个氧原子相连 | |
| D. | 工业上制玻璃的主要原料有:黏土、石灰石、石英 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaCl═Na++Cl- | D. | CH3COOH═CH3COO-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ②⑤ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com