
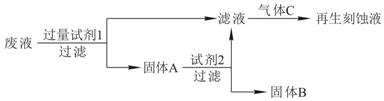
·ÖĪö ¢ń£®ĄūÓĆ·ĻŅŗŌŁÉśFeCl3æĢŹ“Ņŗ£¬Ó¦³żČ„ČÜŅŗÖŠµÄCu2+£¬·ĻŅŗÓė¹żĮæµÄFe·“Ó¦ÖĆ»»³öCu£¬¹żĀĖ£¬¹ĢĢåAĪŖCuÓėFeµÄ»ģŗĻĪļ£¬ĀĖŅŗÖŠČÜÖŹĪŖFeCl2£¬¹ĢĢåAÓėŃĪĖį·“Ӧɜ³ÉFeCl2£¬¹żĀĖ³żČ„Cu£¬FeCl2ÓĆĀČĘųŃõ»ÆµĆµ½FeCl3£»
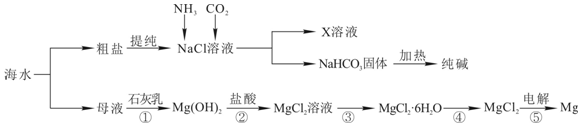
¢ņ£®½«ŗ£Ė®Õō·¢ÅØĖõ”¢ĄäČ“½į¾§µĆµ½“ÖŃĪŗĶÄøŅŗ£¬ĻņÄøŅŗÖŠ¼ÓČėCa£ØOH£©2£¬·¢Éś·“Ó¦Mg2++2OH-=Mg£ØOH£©2”ż£¬¹żĀĖµĆµ½Mg£ØOH£©2³Įµķ£¬½«Mg£ØOH£©2ČÜÓŚĻ”ŃĪĖįÖŠ·¢Éś·“Ó¦Mg£ØOH£©2+2HCl=MgCl2+2H2O£¬½«ČÜŅŗÕō·¢ÅØĖõ”¢ĄäČ“½į¾§µĆµ½MgCl2.6H2O£¬½«MgCl2.6H2O¾§ĢåŌŚHCl·ÕĪ§ÖŠ¼ÓČȵƵ½¹ĢĢå
MgCl2£¬µē½āČŪČŚĀČ»ÆĆ¾µĆµ½Mg£¬·¢Éś·“Ó¦ĪŖMgCl2$\frac{\underline{\;Ķصē\;}}{\;}$Mg+Cl2”ü£»
½«“ÖŃĪĢį“æµĆµ½NaClČÜŅŗ£¬ĻņČÜŅŗÖŠĶØČė°±ĘųŗĶ¶žŃõ»ÆĢ¼£¬·¢Éś·“Ó¦NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl£¬Ģ¼ĖįĒāÄĘČܽā¶ČŠ”ÓŚNaCl¶ųĪö³ö£¬ĖłŅŌµĆµ½ČÜŅŗXĪŖNH4ClČÜŅŗ£¬½«NaHCO3¼ÓČČ·¢Éś·“Ó¦2NaHCO3$\frac{\underline{\;\;”÷\;\;}}{\;}$Na2CO3+CO2”ü+H2O£¬×īŗóµĆµ½Ģ¼ĖįÄĘ¹ĢĢ壬
£Ø1£©“ÓŌŖĖŲµÄ»ÆŗĻ¼ŪŹĒ·ń·¢Éś±ä»ÆµÄ½Ē¶ČÅŠ¶ĻŹĒ·ńŹōÓŚŃõ»Æ»¹Ō·“Ó¦£»
£Ø2£©øł¾ŻĒāŃõ»ÆĆ¾³ĮµķÓėŃĪĖį·“Ӧɜ³ÉĀČ»ÆĆ¾ŗĶĖ®Š“³öĄė×Ó·½³ĢŹ½£»
£Ø3£©øł¾Ż”°ŗņŹĻÖĘ¼ī·Ø”±µÄŌĄķ·ÖĪö£»
£Ø4£©ĪŖÖĘµĆ“æ¾»µÄNaCl¾§Ģ壬ĻČ½«“ÖŃĪČܽā£¬Č»ŗó½«ŌÓÖŹĄė×ÓŠĪ³É³Įµķ£¬¹żĀĖ£¬ŌŁ¼ÓČėŃĪĖį³żČ„·“Ó¦Ź£ÓąµÄĒāŃõøłĄė×ÓŗĶĢ¼ĖįøłĄė×Ó£¬×īŗó¾Õō·¢²Ł×÷µĆµ½½Ļ“æ¾»µÄĀČ»ÆÄĘ£»
£Ø5£©øł¾ŻĀČĄė×ӵļģŃé·½·Ø£®
½ā“š ½ā£ŗ¢ń£®ĄūÓĆ·ĻŅŗŌŁÉśFeCl3æĢŹ“Ņŗ£¬Ó¦³żČ„ČÜŅŗÖŠµÄCu2+£¬·ĻŅŗÓė¹żĮæµÄFe·“Ó¦ÖĆ»»³öCu£¬¹żĀĖ£¬¹ĢĢåAĪŖCuÓėFeµÄ»ģŗĻĪļ£¬ĀĖŅŗÖŠČÜÖŹĪŖFeCl2£¬¹ĢĢåAÓėŃĪĖį·“Ӧɜ³ÉFeCl2£¬¹żĀĖ³żČ„Cu£¬FeCl2ÓĆĀČĘųŃõ»ÆµĆµ½FeCl3£»
£Ø1£©ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬ŹŌ¼Į2ŹĒHCl£¬¹ĢĢåBŹĒCu£¬ĶØČėµÄĘųĢåCŹĒCl2£¬
¹Ź“š°øĪŖ£ŗHCl£»Cu£»Cl2£»
£Ø2£©¼ÓČėŹŌ¼Į1·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗFe+2Fe3+=3Fe2+”¢Fe+Cu2+=Fe2++Cu£¬
¹Ź“š°øĪŖ£ŗFe+2Fe3+=3Fe2+”¢Fe+Cu2+=Fe2++Cu£»
¢ņ£®½«ŗ£Ė®Õō·¢ÅØĖõ”¢ĄäČ“½į¾§µĆµ½“ÖŃĪŗĶÄøŅŗ£¬ĻņÄøŅŗÖŠ¼ÓČėCa£ØOH£©2£¬·¢Éś·“Ó¦Mg2++2OH-=Mg£ØOH£©2”ż£¬¹żĀĖµĆµ½Mg£ØOH£©2³Įµķ£¬½«Mg£ØOH£©2ČÜÓŚĻ”ŃĪĖįÖŠ·¢Éś·“Ó¦Mg£ØOH£©2+2HCl=MgCl2+2H2O£¬½«ČÜŅŗÕō·¢ÅØĖõ”¢ĄäČ“½į¾§µĆµ½MgCl2.6H2O£¬½«MgCl2.6H2O¾§ĢåŌŚHCl·ÕĪ§ÖŠ¼ÓČȵƵ½¹ĢĢå
MgCl2£¬µē½āČŪČŚĀČ»ÆĆ¾µĆµ½Mg£¬·¢Éś·“Ó¦ĪŖMgCl2$\frac{\underline{\;Ķصē\;}}{\;}$Mg+Cl2”ü£»
½«“ÖŃĪĢį“æµĆµ½NaClČÜŅŗ£¬ĻņČÜŅŗÖŠĶØČė°±ĘųŗĶ¶žŃõ»ÆĢ¼£¬·¢Éś·“Ó¦NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl£¬Ģ¼ĖįĒāÄĘČܽā¶ČŠ”ÓŚNaCl¶ųĪö³ö£¬ĖłŅŌµĆµ½ČÜŅŗXĪŖNH4ClČÜŅŗ£¬½«NaHCO3¼ÓČČ·¢Éś·“Ó¦2NaHCO3$\frac{\underline{\;\;”÷\;\;}}{\;}$Na2CO3+CO2”ü+H2O£¬×īŗóµĆµ½Ģ¼ĖįÄĘ¹ĢĢ壬
£Ø1£©¢ŁŹÆ»ŅČéÓėĀČ»ÆĆ¾·“Ӧɜ³ÉĒāŃõ»ÆĆ¾³ĮµķŗĶĀČ»ÆøĘ£¬ŌŖĖŲ»ÆŗĻ¼Ū²»±ä£¬·ĒŃõ»Æ»¹Ō·“Ó¦£»
¢ŚĒāŃõ»ÆĆ¾³ĮµķÓėŃĪĖį·“Ӧɜ³ÉĀČ»ÆĆ¾ŗĶĖ®£¬ŌŖĖŲ»ÆŗĻ¼Ū²»±ä£¬·ĒŃõ»Æ»¹Ō·“Ó¦£»
¢ŪĀČ»ÆĆ¾ČÜŅŗÕō·¢ÅØĖõµĆµ½ĀČ»ÆĆ¾¾§Ģ壬ŌŖĖŲ»ÆŗĻ¼Ū²»±ä£¬·ĒŃõ»Æ»¹Ō·“Ó¦£»
¢ÜĀČ»ÆĆ¾¾§Ģå·Ö½āµĆµ½ĀČ»ÆĆ¾ŗĶĖ®£¬ŌŖĖŲ»ÆŗĻ¼Ū²»±ä£¬·ĒŃõ»Æ»¹Ō·“Ó¦£»
¢Żµē½āĀČ»ÆĆ¾µĆµ½Ć¾ŗĶĀČĘų£¬ŌŖĖŲ»ÆŗĻ¼Ū·¢Éś±ä»Æ£¬Ńõ»Æ»¹Ō·“Ó¦£»
¹ŹŃ”¢Ż£¬
¹Ź“š°øĪŖ£ŗ¢Ż£»
£Ø2£©ĒāŃõ»ÆĆ¾³ĮµķÓėŃĪĖį·“Ӧɜ³ÉĀČ»ÆĆ¾ŗĶĖ®£¬·½³ĢŹ½ĪŖ£ŗMg£ØOH£©2+2HCl=MgCl2+2H2O£¬Ąė×Ó·½³ĢŹ½ĪŖ£ŗMg£ØOH£©2+2H+=Mg2++2H2O£¬
¹Ź“š°øĪŖ£ŗMg£ØOH£©2+2H+=Mg2++2H2O£»
£Ø3£©ĻņĀČ»ÆÄĘČÜŅŗÖŠŅĄ“ĪĶØČė°±Ęų”¢¶žŃõ»ÆĢ¼£¬·¢Éś·“Ó¦£ŗNH3+CO2+H2O=NH4HCO3£»NH4HCO3+NaCl=NH4Cl+NaHCO3”ż£¬ĖłŅŌČÜŅŗÖŠŗ¬ÓŠNH4ClŗĶNaHCO3£¬ŌņČÜŅŗÖŠµÄÖ÷ŅŖŃōĄė×ÓŹĒNa+ŗĶNH4+£»
¹Ź“š°øĪŖ£ŗNH4+£»
£Ø4£©Ź×ĻČŅŖ°Ń“ÖŃĪČÜÓŚĖ®ŠĪ³ÉČÜŅŗ£¬Č»ŗóĆ¾Ąė×ÓÓĆĒāŃõøłĄė×Ó³Įµķ£¬¼ÓČė¹żĮæµÄĒāŃõ»ÆÄĘæÉŅŌ½«Ć¾Ąė×Ó³Įµķ£¬ĮņĖįøłĄė×ÓÓƱµĄė×Ó³Įµķ£¬¼ÓČė¹żĮæµÄĀČ»Æ±µæÉŅŌ½«ĮņĖįøłĄė×Ó³Įµķ£¬ÖĮÓŚĻČ³żĆ¾Ąė×Ó£¬»¹ŹĒĻČ³żĮņĖįøłĄė×Ó¶¼ŠŠ£¬øĘĄė×ÓÓĆĢ¼ĖįøłĄė×Ó³Įµķ£¬³żøĘĄė×Ó¼ÓČėĢ¼ĖįÄĘ×Ŗ»ÆĪŖ³Įµķ£¬Ca2++CO32-=CaCO3”ż£¬µ«ŹĒ¼ÓČėµÄĢ¼ĖįÄĘŅŖ·ÅŌŚ¼ÓČėµÄĀČ»Æ±µÖ®ŗó£¬ÕāŃłĢ¼ĖįÄĘ»į³żČ„·“Ó¦Ź£ÓąµÄĀČ»Æ±µ£¬Ba2++CO32-=BaCO3”ż£¬Ąė×Ó¶¼³ĮµķĮĖ£¬ŌŁ½ųŠŠ¹żĀĖ£¬×īŗóŌŁ¼ÓČėŃĪĖį³żČ„·“Ó¦Ź£ÓąµÄĒāŃõøłĄė×ÓŗĶĢ¼ĖįøłĄė×Ó£¬×īŗó¾Õō·¢²Ł×÷µĆµ½½Ļ“æ¾»µÄĀČ»ÆÄĘ£»
¹Ź“š°øĪŖ£ŗ¹żĀĖ£»Õō·¢½į¾§£»
£Ø5£©ĀČĄė×ÓÄÜŗĶĻõĖįĖį»ÆµÄĻõĖįŅųČÜŅŗ·“Ӧɜ³ÉĀČ»ÆŅų°×É«³Įµķ£¬ĖłŅŌ¼ģŃé“æ¼īѳʷ֊ŹĒ·ńŗ¬NaClӦєÓƵďŌ¼ĮŹĒĻ”ĻõĖį”¢AgNO3ČÜŅŗ£»
¹Ź“š°øĪŖ£ŗĻ”ĻõĖį”¢AgNO3ČÜŅŗ£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹÖʱø·½°ø”¢ĪļÖŹ·ÖĄėĢį“æ×ŪŗĻÓ¦ÓĆ”¢ŗ£Ė®µÄ×ŪŗĻĄūÓĆ£¬Éę¼°½šŹōÖʱø”¢ŗņŹĻÖĘ¼ī·Ø”¢“ÖŃĪĢį“æµČ£¬²ąÖŲæ¼²éѧɜ¶ŌŌĄķ”¢ŹŌ¼Į”¢²Ł×÷µÄ·ÖĪöĘĄ¼Ū£¬ŹĒ¶Ōѧɜ×ŪŗĻÄÜĮ¦µÄ漲飬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1£ŗ1£ŗ1 | B£® | 2£ŗ2£ŗ1 | C£® | 1£ŗ3£ŗ2 | D£® | ĪŽ·Ø¼ĘĖć |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 0.1 mol•L-1 pH=7.82 µÄ NH4HCO3 ČÜŅŗÖŠ£ŗc£ØHCO3-£©£¾c£ØNH4+£©£¾c£ØOH-£©£¾c£ØH+£© | |
| B£® | 0.1 mol•L-1 Na2SČÜŅŗÖŠ£ŗc£ØOH-£©=c£ØH+£©+c£ØHS-£©+2c£ØH2S£© | |
| C£® | ÅØ¶Č¾łĪŖ 0.1 mol•L-1µÄNH3•H2O ČÜŅŗŗĶ NH4Cl ČÜŅŗµČĢå»ż»ģŗĻ£ŗc£ØNH4+£©+c£ØH+£©£¾c£ØNH3•H2O£©+c£ØOH-£© | |
| D£® | 0.1 mol•L-1 Na2S ČÜŅŗÓė 0.1 mol•L-1 NaHS ČÜŅŗµČĢå»ż»ģŗĻ£ŗ2c£ØNa+£©-3c£ØS2-£©=3c£ØHS-£©+3c£ØH2S£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | b£¾a£¾c | B£® | c£¾a£¾b | C£® | c£¾b£¾a | D£® | a£¾b£¾c |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĘĻĢŃĢĒµÄČ¼ÉÕČČŹĒ2800 kJ•mol-1£¬Ōņ$\frac{1}{2}$C6H12O6£Øs£©+3O2£Øg£©ØT3CO2£Øg£©+3H2O£Øl£©”÷H=-1400 kJ•mol-1 | |
| B£® | ŅŃÖŖ101 kPaŹ±£¬2C£Øs£©+O2£Øg£©ØT2CO£Øg£©”÷H=-221 kJ•mol-1£¬ŌņøĆ·“Ó¦µÄ·“Ó¦ČČĪŖ221 kJ•mol-1 | |
| C£® | ŅŃÖŖĻ”ČÜŅŗÖŠ£¬H+£Øaq£©+OH-£Øaq£©ØTH2O£Øl£©”÷H=-57.3 kJ•mol-1£¬ŌņĻ”“×ĖįÓėĻ”ĒāŃõ»ÆÄĘČÜŅŗ·“Ӧɜ³É1 molĖ®Ź±·Å³ö57.3 kJµÄČČĮæ | |
| D£® | ŅŃÖŖHClŗĶNaOH·“Ó¦µÄÖŠŗĶČČ”÷H=-57.3 kJ•mol-1£¬Ōņ98%µÄÅØĮņĖįÓėĻ”ĒāŃõ»ÆÄĘČÜŅŗ·“Ӧɜ³É1 molĖ®µÄÖŠŗĶČČĪŖ-57.3 kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| X | Y | W | |
| n£ØĘšŹ¼×“Ģ¬£©/mol | 2 | 1 | 0 |
| n£ØĘ½ŗāדĢ¬£©/mol | 1 | 0.5 | 1.5 |
| A£® | “Ė·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½ŹĒK=$\frac{{c}^{2}£ØX£©•c£ØY£©}{{c}^{3}£ØW£©}$ | |
| B£® | “ļµ½Ę½ŗāŗó£¬ÉżøßĪĀ¶Č£¬WµÄĢå»ż·ÖŹż¼õÉŁ£¬Ōņ“Ė·“Ó¦µÄ”÷H£¾0 | |
| C£® | “ļµ½Ę½ŗāŗó£¬Ōö“óŃ¹Ēæ£¬Õż”¢Äę·“Ó¦ĖŁĀŹ¾łŌö“ó£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ | |
| D£® | “ļµ½Ę½ŗāŗ󣬽«ČŻĘ÷Ģå»żŃ¹ĖõĪŖ2L£¬WµÄĪļÖŹµÄĮæÅØ¶Č±äĪŖ0.75mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓƵķ·ŪKIŹŌÖ½¼ų±šäåÕōĘųŗĶNO2ĘųĢå | |
| B£® | Ö¤Ć÷Fe2O3ŹĒ¼īŠŌŃõ»ÆĪļ£¬æɽ«ĘäÓėŃĪĖį»ģŗĻ£¬¹Ū²ģĻÖĻó | |
| C£® | ČōNaOHČÜŅŗ²»É÷Õ“µ½Ę¤·ōÉĻ£¬Ó¦øĆĮ¢¼“ÓĆ“óĮæµÄĮņĖįĒåĻ“ | |
| D£® | ³żČ„MnO2ÖŠµÄŌÓÖŹKMnO4£¬æɽ«¹ĢĢåČÜÓŚĖ®ŗó¹żĀĖ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com