
| A. | 0.1mol/LNa2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(C032-) | |
| B. | 向0.1mol/L氯化铵溶液中滴加浓盐酸可能有c(NH4+)=c(H+) | |
| C. | pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH>7 | |
| D. | 将0.2mol/LNaA溶液和某浓度的盐酸等体积混合所得中性溶液中:c(Na+)=c(A-)+c(Cl-)=0.2mol/L |
分析 A、根据溶液中的物料守恒来书写;
B、氯化铵溶液中铵根离子会发生水解,加入酸可以抑制水解;
C、pH=4的醋酸与pH=10的NaOH溶液等体积混合后,醋酸会剩余;
D、根据电荷守恒c(Na+)+(H+)=c(A-)+c(Cl-)+c(OH-)分析解答.
解答 解:A、根据物料守恒,可知:c(Na+)=2c(HCO3-)+2c(H2CO3)+2c(CO32-),故A错误;
B、向溶液中加滴加几滴浓盐酸,抑制NH4+的水解,如加入盐酸较多,可能使c(NH4+)=c(H+),故B正确;
C、pH=4的醋酸与pH=10的NaOH溶液等体积混合后得到醋酸钠和醋酸的混合物,以醋酸的电离为主溶液呈酸性,所以pH<7,故C错误;
D、根据电荷守恒,c(Na+)+(H+)=c(A-)+c(Cl-)+c(OH-),而溶液呈中性,所以c(Na+)=c(A-)+c(Cl-)=0.1mol/L,故D错误;
故选B.
点评 本题考查离子浓度大小比较,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握盐类水解的规律,结合电荷守恒解答该题,难度中等.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl Na+${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$ | B. | H2S H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{S}}{••}$${\;}_{•}^{•}$]2-H+ | ||
| C. | N2 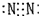 | D. | NH4I 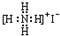 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
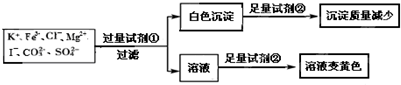
| A. | 该溶液中一定有I-、CO32-、SO42-、K+ | |
| B. | 试剂①为硝酸钡 | |
| C. | 通过黄色溶液中加入硝酸银可以检验原溶液中是否存在Cl- | |
| D. | 试剂②一定为盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生铅中毒时,可喝大量的牛奶或鸡蛋清来缓解病情 | |
| B. | CO2的水溶液呈酸性,CO2的大量排放会导致酸雨的形成 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
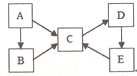 构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系:
构建知识网络体系,有助于知识的有序储存和应用.下图A、B、C、D、E五种物质均含有同一种元素,它们之间有如图转化关系: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
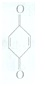 (对苯醌)═N2H4+
(对苯醌)═N2H4+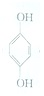 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为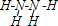 ,该电池正极的电极反应式为
,该电池正极的电极反应式为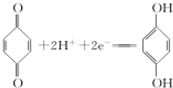 .
.| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Na2O2后的溶液中:K+、AlO2-、NO3-、SO32- | |
| B. | 水电离的c(H+ )=1×10-13 mol•L-1的溶液中:Fe2+、Mg 2+、SO42-、NO3- | |
| C. | 通入足量SO2后的溶液中:Ba2+、Fe2+、H2SO3、Cl- | |
| D. | 0.1mol•L-1 KMnO4酸性溶液中:H2O2、NH4+、Br2、SO4 2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
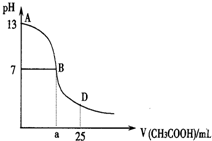 如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )| A. | c(OH-)大于、小于或等于c(CH3COO-) | B. | c(OH-)一定等于c(CH3COO-) | ||
| C. | c(OH-)一定小于c(CH3COO-) | D. | c(OH-)一定大于c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:
天然气含有硫化氢气体,回收并综合利用硫化氢有重要的经济价值和环境保护意义.如硫化氢可经过一系列反应制得硫酸:时间 物质 | 0min | 20min | 60min | 90min | 120min |
| H2S | 0.006 | 0.005 | |||
| H2 | 0 | 0.002 | 0.004 | ||
| S2 | 0 | 0.002 | 0.0025 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com