
【题目】短周期元素的原子,处于基态时可能具有的电子是( )
A.只有s或s和p电子B.只有s电子C.只有p电子D.有s、p和d电子
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】已知苯可以进行如下转化:
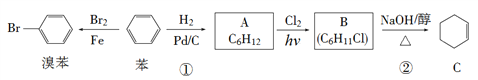
回答下列问题:
(1)反应①的反应类型为________,化合物A的化学名称为___________。
(2)化合物B的结构简式为_________,反应②的反应类型为_______。
(3)如何仅用水鉴别苯和溴苯__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究浓硫酸与蔗糖的炭化产物,设计下图装置进行实验(a和b分別为两个气球)。

已知:CO气体通入氯化钯溶液,溶液变为黑色。
实验过程如下:
I .按图示连接好仪器,然后检验装置的气密性。
II.在双通玻璃管中①②③④处分别放罝滴有酸性高锰酸钾溶液的滤纸、滴有品红溶液的滤纸、浸有氯化钯溶液的滤纸和浸有溴水的滤纸。
III.夹好止水夹K,向三颈烧瓶A中的蔗糖上滴3~4滴蒸馏水,再加入3 mL浓硫酸,玻璃管中③处滤纸由白色变为黑色。
IV.打开止水夹K,使烧瓶内气体缓慢通过B和C装置,一段时间之后,发现④处的滤纸颜色没有发生变化,C中的澄清石灰水变浑浊。
(1)装置A中盛装浓硫酸的仪器名称为______;上述实验体现了硫酸的那些性质_____。
(2)实验步骤III中,向蔗糖上滴水的目的是_________________;
(3)若反应生成两种碳的氧化物相同条件下的体积相同,写出蔗糖炭化后发生反应的化学反应方程式_________。
(4)步骤IV的实验目的是_______________________。
(5)该实验体现了“微型实验”绿色环保的优点,有人建议将装置B改为滴有酸性高锰酸钾溶液的滤纸置于后面的双通玻璃管中,你对该改进建议的评价是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3-t4阶段为使用催化剂。
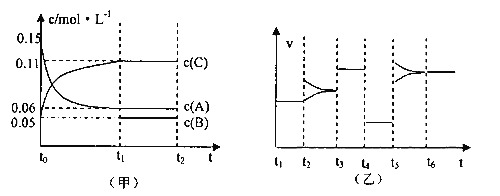
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率v(C)为=_________________。
(2)若t2—t3阶段,C的体积分数变小,此阶段v(正)_____________v(逆)(填“>”“<”“=”)
(3)t4—t5阶段改变的条件为_________________,B的起始物质量为_________________。
(4)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
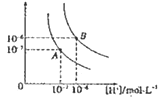
A. 纯水中25℃时的c(H+)比100℃时的c(H+)大
B. 25℃时某溶液中由水电离产生的c( H+)> =1×10-ll molL-1,则该溶液的pH可能是11或3
C. 将pH = 9的Ba(OH)2溶液与pH =4的稀盐酸混合,并保持100 ℃的恒温,混合溶液的PH=7,则此Ba(OH)2的溶液和盐酸的体积比为10:1
D. 100℃时,某 NaS04 溶液中 c(S042- ) =5 ×10 -4mol L-1,则溶液中 c(Na+): c(OH-)为104:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从化学键的观点看,化学反应的实质是“旧键的断裂,新键的形成”,据此你认为下列变化属于化学反应的是( )
A. 对空气进行降温加压 B. 金刚石变成石墨
C. NaCl熔化 D. 碘溶于CCl4中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
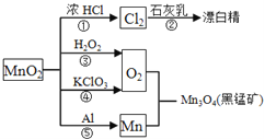
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1︰1
D. 反应①中氧化剂与还原剂的物质的量之比为1︰4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氮的化合物引起的环境污染称为氮污染。
(1)己知CO将NO转化为N2的方程式为2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH,某研究小组在实验中研究温度对NO转化率的影响并绘制图像。
N2(g)+2CO2(g) ΔH,某研究小组在实验中研究温度对NO转化率的影响并绘制图像。
①当n(NO)/n(CO)=l,容器容积恒定时,在不同温度下反应相同的时间测得NO的转化率变化如图所示,则在此反应时间内应控制反应的最佳温度在______左右,该反应的ΔH_____0 (填>或<)。

②该反应的平衡常数表达式为K=__________。
要同时提高平衡常数的值和NO的平衡转化率,可采取的措施是________。
A.降低温度 B.及时将CO2和N2从反应体系中移走
C.升高温度 D.增大压强
③在恒温恒容容器中按体积比2∶1充入CO和NO的混合气体,下列选项能说明正反应速率大于逆反应速率的是_____________(填序号)。
A.CO的浓度保持恒定 B.混合气体的平均相对分子质量逐渐减小
C.CO和NO的物质的量之比逐渐增大 D.CO、NO、N2的速率之比为2∶2∶1
(2)在催化剂存在的条件下,用H2可以将NO还原为N2,己知:

则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_________________。
(3)MAP沉淀法是一种比较新颖有效的处理氨氮废水的方法,.原理如下:向含NH4+的废水中投加磷酸盐和镁盐,使之和NH4+生成难溶复盐MgNH4PO4·6H2O (简称MAP)。MAP沉淀法需要控制反应的PH在7.5-10之间,当PH过高时不利于生成MAP的原因是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com