
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。图中横坐标表示加入NaOH溶液的体积,纵坐标表示生成沉淀的质量,有关说法正确的是( )

A.V1=400
B.金属粉末中含铝1.35 g
C.最后剩余沉淀质量5.8 g
D.无法确定V2的数值
【答案】A
【解析】
NaOH溶液的体积为0-160mL时,NaOH溶液用于中和反应剩余的硫酸,NaOH溶液的体积为160-V1mL时,NaOH溶液用于沉淀Mg2+和Al3+,NaOH溶液的体积为V1-V2mL时,NaOH溶液用于溶解所有的Al(OH)3沉淀,据此进行计算。
NaOH溶液的体积为0-160mL时,NaOH溶液用于中和反应剩余的硫酸,NaOH溶液的体积为160-V1mL时,NaOH溶液用于沉淀Mg2+和Al3+,NaOH溶液的体积为V1-V2mL时,NaOH溶液用于溶解所有的Al(OH)3沉淀,那么
A. 加入V1mLNaOH时,溶液中溶质为 Na2SO4,由硫酸根守恒n( Na2SO4)=n(H2SO4)=0.1L×2mol/L=0.2mol,由钠离子守恒n( NaOH)=2n( Na2SO4)=0.2mol×2=0.4mol,因此V1mL时消耗NaOH溶液体积为:![]() =0.4L=400mL, A项正确;
=0.4L=400mL, A项正确;
B. NaOH溶液的体积为160-V1mL时,NaOH溶液用于生成Mg(OH)2、Al(OH)3沉淀,根据电荷守恒可知,金属提供电子物质的量为(0.4L﹣0.16L)×1mol/L=0.24mol,设Mg、Al的物质的量分别为xmol、ymol,则:x+y=0.1,2x+3y=0.24,联立解得x=0.06,y=0.04,故Al的质量为0.04mol×27g/mol=1.08g,B项错误;
C. 最终剩余的沉淀为Mg(OH)2,结合Mg原子守恒可知,Mg(OH)2为0.06mol,其质量为0.06mol×58g/mol=3.48g,C项错误;
D. 由Al原子守恒可知Al(OH)3为0.04mol,由Al(OH)3+NaOH=NaAlO2+H2O可知,溶解Al(OH)3消耗NaOH为0.04mol,故需要NaOH溶液体积为![]() =0.04L=40mL,因此V2=240+40=280,D项错误;
=0.04L=40mL,因此V2=240+40=280,D项错误;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用NaCl固体配制100mL2.0mol·L1NaCl溶液,请回答下列问题。
(1)用到的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和__。
(2)用托盘天平称取NaCl固体的质量是__g。
(3)下列情况中,会使所配溶液浓度偏高的是__(填字母)。
A.定容时,俯视刻度线 B.转移液体时,有少量液体洒出
C.加蒸馏水超过了刻度线 D.没有洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解锰工艺过程会产生锰、镁复盐,其组成为(NH4)7MnMg2(SO4)6.521H2O。一种综合利用该复盐的工艺流程如图所示:
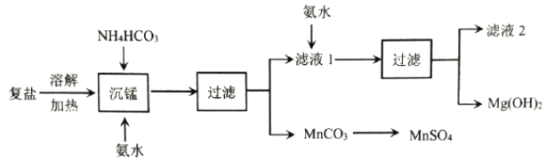
已知:Ksp[Mg(OH)2]=1.8×10-11,Kb(NH3H2O)=1.8×10-5。回答下列问题:
(1)(NH4)7MnMg2(SO4)6.521H2O的水溶液呈__________________性(填“酸”或“碱”) ,Mn的化合价为__________________。
(2)“沉锰”的离子反应方程式为__________________;滤液1溶质的主要成分有__________________。
(3)“沉锰”过程中pH和温度对Mn2+和Mg2+沉淀率的影响如图所示:
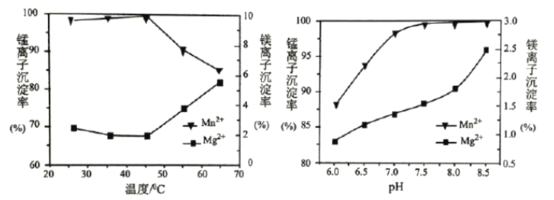
①由图可知,“沉锰”合适的条件为__________________。
②Mg2+主要生成的是__________________沉淀(填“Mg(OH)2”或“MgCO3”),当温度高于45℃时Mg2+和Mn2+沉淀率的变化如图所示,原因是__________________。
(4)若将NH3通入0.01molL-1MgSO4溶液至Mg2+完全沉淀,则此时溶液中NH3H2O的物质的量浓度为__________________。(已知![]() =1.34,忽略反应前后溶液体积的变化,计算结果保留两位有效数字)
=1.34,忽略反应前后溶液体积的变化,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将二氧化钛(TiO2)光电极嵌入到新型钠离子电池的正极,由于光电势的补偿,电池的充电电位下降。该光电极辅助充电时的工作原理如图所示,下列说法错误的是

A.充电时阳极的电极反应式为3I--2e-=I3-
B.放电时,a极发生氧化反应
C.放电时,正、负极反应的微粒数目比为4:3
D.辅助充电时,光能转化为电能,再转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类应用较早,当前应用量最大的金属元素。下列有关说法中正确的是( )
A.人类使用铁制品在铝之后
B.常温下,铁不能与浓硝酸反应
C.铁与水蒸气在高温下的反应产物为Fe2O3和H2
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加入适量氯水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
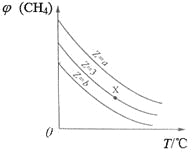
A. 该反应的焓变ΔH>0
B. 图中Z的大小为a>3>b
C. 图中X点对应的平衡混合物中![]() =3
=3
D. 温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:

(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH-=H2O还有:
_____________________________、________________________________;
(3)步骤③中通入过量CO2气体的离子方程式有______________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙(如下图)三种晶体的晶胞(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶胞中x与y的个数比是__________,乙晶胞中a与b的个数比是__________,丙晶胞中有________个c离子,有________个d离子。
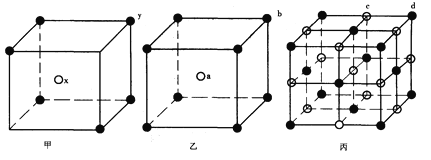
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备N2H4·H2O(水合肼)和无水Na2SO3主要实验流程如下:

已知:① 氯气与烧碱溶液的反应是放热反应;
② N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。
⑴从流程分析,本流程所用的主要有机原料为_______________(写名称)。
⑵步骤Ⅰ制备NaClO溶液时,若温度为41℃,测得产物中除NaClO外还含有NaClO3,且两者物质的量之比为5∶1,该反应的离子方程式为____________________。
⑶实验中,为使步骤Ⅰ中反应温度不高于40 ℃,除减缓Cl2的通入速率外,还可采取的措施是_________________。
⑷步骤Ⅱ合成N2H4·H2O(沸点约118 ℃)的装置如图。NaClO碱性溶液与尿素[CO(NH2)2](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。
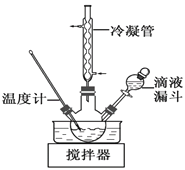
① 使用冷凝管的目的是_________________。
② 滴液漏斗内的试剂是_______;
将滴液漏斗内的液体放入三颈烧瓶内的操作是______________________________;
③ 写出流程中生成水合肼反应的化学方程式________________________________。
⑸ 步骤Ⅳ制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图所示)。

① 边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定停止通SO2的pH值为____(取近似整数值,下同);
②用制得的NaHSO3溶液再制Na2SO3溶液的pH应控制在________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com