
| A. | 只须验证它完全燃烧后产物只有H2O和CO2 | |
| B. | 只须测定其燃烧产物中H2O 和CO2 物质的量的比值 | |
| C. | 测定完全燃烧时消耗有机物与生成的H2O、CO2 的物质的量之比 | |
| D. | 测定该试样的质量及试样完全燃烧后生成H2O 和CO2 的质量 |
分析 A.无论有机物是否含有O元素,烃的含氧衍生物或烃燃烧都生成H2O和CO2;
B.测定其燃烧产物中H2O和CO2物质的量的比值只能确定C、H元素的比值,不能确定是否含有O;
C.测定完全燃烧时消耗有机物与生成的CO2、H2O的物质的量之比,只能确定C、H元素的比值,不能确定是否含有O;
D.从质量守恒的角度分析.
解答 解:A.烃的含氧衍生物或烃燃烧都生成H2O和CO2,不能确定是否含有O,故A错误;
B.测定其燃烧产物中H2O和CO2物质的量的比值只能确定C、H元素的比值,不能确定是否含有O,故B错误;
C.测定完全燃烧时消耗有机物与生成的CO2、H2O的物质的量之比,只能确定C、H元素的比值,不能确定是否含有O,故C错误;
D.测定该试样的质量及其试样完全燃烧后生成CO2和H2O的质量,可以确定一定质量的有机物中含有C、H元素的质量,根据质量守恒可确定是否含有O元素,故D正确.
故选D.
点评 本题考查有机物分子的元素组成,侧重于学生的分析能力的评价,题目难度不大,注意从质量守恒的角度分析,把握测定原理.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:计算题
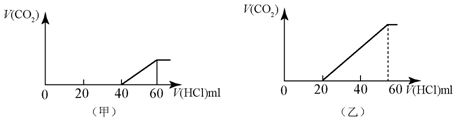
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
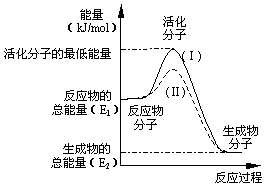 请认真观察图并利用所学的活化能的知识,回答下列问题:
请认真观察图并利用所学的活化能的知识,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | abc | B. | bcd | C. | abd | D. | abcd |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸和醇发生的反应一定是酯化反应 | |
| B. | 由乙烯生成乙醇属于还原反应 | |
| C. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com