
����Ŀ������ˮ��IJ��C6H12O6�����������������Ʊ����ᣬװ����ͼ1��ʾ�����ȡ�����������̶�װ�þ�����ȥ����ʵ�������ͼ1��
�ٽ�1��1�ĵ���ˮ��Һ���������ᣨ98%�������ձ��У�ˮԡ������85�桫90�棬����30min��Ȼ�����¶Ƚ���60�����ң�
�ڽ�һ�����ĵ���ˮ��Һ����������ƿ�У�
�ۿ��Ʒ�ӦҺ�¶���55��60�������£��߽�������μ�һ�����������������Ļ��ᣨ65%HNO3��98%H2SO4��������Ϊ2��1.5����Һ��
�ܷ�Ӧ3h���ң���ȴ����ѹ���˺�ò��ᾧ���Ʒ�����ؽᾧ�ò��ᾧ�壮������������ˮ��Һ�����пɷ������з�Ӧ��
C6H12O6+12HNO3��3H2C2O4+9NO2��+3NO��+9H2O
C6H12O6+8HNO3��6CO2+8NO��+10H2O
3H2C2O4+2HNO3��6CO2+2NO��+4H2O
��ش��������⣺
��1��ʵ��ټ���98%����������Ŀ���ǣ� ��
��2������ˮ�Ľ���������a��b����ʵ����������μӹ��죬�����²�������½�����ԭ���� ��
��3��װ��B�������� �� Ϊʹβ��������գ�C���Լ��� ��
��4���ؽᾧʱ�������ᾧ���Ʒ���ټ����ܽ⡢�ڳ��ȹ��ˡ�����ȴ�ᾧ���ܹ���ϴ�Ӣݸ����ʵ�鲽�裬�õ��ϴ����IJ��ᾧ�壮�ù����пɽ���Ʒ���ܽ�Ƚϴ����������������������ţ�ʱ��ȥ������Ʒ���ܽ�Ƚ�С��������������������ֽ�ϡ�����Һ�С�����
��5������Ʒ�ں�������Լ90�����º�������أ��õ���ˮ�ϲ��ᣮ
��KMnO4����Һ�ζ����÷�Ӧ�����ӷ���ʽΪ�� �� ��ȡ����Ʒ������ˮ��ȫ�ܽ⣬Ȼ����0.02000molL��1������KMnO4��Һ�ζ����յ㣨���ʲ����뷴Ӧ�����ζ�ǰ��ζ����е�Һ�������ͼ2��������KMnO4��Һ�����Ϊ ��
���𰸡�
��1���ӿ����ˮ����ٶȣ������������ã�
��2��a,�¶ȹ���,����Ũ�ȹ���,����H2C2O4��һ��������
��3������ȫƿ,NaOH��Һ
��4����,��ֽ��
��5��2MnO4��+5C2O42��+16H+=2Mn2++10CO2��+8H2O,16.00mL
���������⣺��1��Ũ�������ǿ�����ԡ���ˮ�Ժ���ˮ�ԣ�����ʵ���ǽ�C6H12O6���������������Ʊ����ᣬŨ������������Ũ������ˮ�����������ɲ���ķ����ƶ���
���Դ��ǣ��ӿ����ˮ����ٶȣ������������ã�����2������Ч������Ч���ã�����ˮ�Ľ�����a��b��������Ϊ65%HNO3��98%H2SO4�Ļ��Һ�����Һ����ˮ���ȣ��¶ȸ��ܼӿ컯ѧ��Ӧ�������ܽ�һ������H2C2O4�ɶ�����̼��
���Դ��ǣ�a���¶ȹ��ߣ�����Ũ�ȹ�����H2C2O4��һ������������3��װ��B�������Ƿ�ֹ����װ�ú�����װ�ü䷢����������ȫƿ�����ã���Ӧ��β�����е������������Ⱦ��������Ҫ������������Һ���գ�����C���Լ���NaOH��Һ��
���Դ��ǣ�����ȫƿ��NaOH��Һ����4����������ʵ�鲽���֪��ͨ���ؽᾧ�ò��ᾧ��ʱ�����ᾧ���������ܽ�Ƚϴ������������Һ�У�Ӧ���ڲ�����г�ȥ���ܽ�Ƚ�С������������ʱ������ֽ�ϣ�
���Դ��ǣ��ܣ���ֽ�ϣ���5�������������£�������������ܺͲ��ᷢ��������ԭ��Ӧ���ɶ��������ӡ�������̼��ˮ�����ӷ���ʽΪ2MnO4��+5C2O42��+16H+=2Mn2++10CO2��+8H2O��
ͼʾ�ζ���������Һ���Ϊ��18.50mL��2.50mL=16.00mL��
���Դ��ǣ�2MnO4��+5C2O42��+16H+=2Mn2++10CO2��+8H2O��16.00mL��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е����ӷ���ʽ��ȷ�������� ��
A. �ô���ʯ��ϡ�����ƶ�����̼��CO32��+2H��==H2O+CO2��
B. ������Һ�м���Mg��OH��2��2H++ Mg��OH��2==Mg2+ +2H2O
C. ������������Һ�м�������Һ��SO42-+Ba2+= BaSO4��
D. ����ϡ���ᷴӦ��Fe +6H+ ==2Fe3+ +3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڴ������������ʺͷǵ���ʵ���ȷ�����
������ | ����� | ����� | �ǵ���� | |
A | ���� | ��Ȼ�� | ���� | �ɱ� |
B | �������� | ������Һ | ��ʯ�� | �������� |
C | ���� | ʯ��ˮ | ���Լ� | ���� |
D | ���� | ���Ͻ� | �Ȼ��� | ���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������о����ۻ���NaOH��SiO2��CaO��CCl4 �� ��Ҫ�˷������������âٹ��ۼ������Ӽ��۷��Ӽ�����������ȷ��˳���ǣ� ��
A.�ڢ٢ڢ�
B.�٢ڢڢ�
C.�ڢۢڢ�
D.�٢٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ԭ��ӦFe+H2SO4��FeSO4��H2�������һ��ԭ��أ���װ��ͼ��ע���缫���ơ���Ӧ���ͣ�д���缫��Ӧʽ��
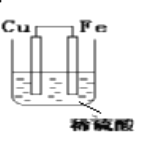
������_____�����缫��Ӧ��___________________________ _________��Ӧ
������_____�����缫��Ӧ��___________________________ _________��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4A��s��+3B��g��2C��g��+D��g������2min B��Ũ�ȼ���0.6molL��1 �� �Դ˷�Ӧ���ʵ���ȷ��ʾ�ǣ� ��
A.��A��ʾ�ķ�Ӧ������0.8 molL��1s��1
B.�ֱ���B��C��D��ʾ��Ӧ�����ʣ����ֵ��3��2��1
C.��2 minĩʱ�ķ�Ӧ���ʣ��÷�Ӧ��B����ʾ��0.3 molL��1min��1
D.����2 min����B��C��ʾ�ķ�Ӧ���ʵ�ֵ������ͬ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������·���ĸ����طֱ�װ��0.5molL��1��������Һ���ö��Ե缫��⣬����ֱ����Դһ��ʱ�����ҺpH�����ǣ� ��
A.KNO3��Һ
B.NaCl��Һ
C.AgNO3��Һ
D.CuCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�����µIJ�ͬ���壬Ӱ���������С����Ҫ�����ǣ� ��
A.���ӵĴ�СB.���ӵ���Ŀ
C.���Ӽ�ľ���D.�¶Ⱥ�ѹǿ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com