
【题目】在实验室里,用足量的浓盐酸与一定量的高锰酸钾反应(不加热),来制取氯气。
反应:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)“双线桥法”标出电子转移情况________。
(2)若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
①理论上需要多少克KMnO4参加反应?________。
②被氧化的HCl的物质的量为多少?________。
【答案】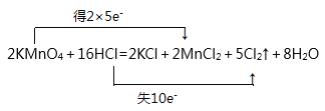 6.32g 0.2 mol
6.32g 0.2 mol
【解析】
(1)根据元素化合价升降数目等于反应过程中电子转移数目分析,标出电子转移情况;
(2)先计算Cl2的物质的量,然后根据方程式中KMnO4、HCl与Cl2之间的反应转化关系计算。
(1)在该反应中,Mn元素化合价由反应前KMnO4中的+7价变为反应后MnCl2中的+2价,化合价降低,得到5个电子,Cl元素化合价由反应前HCl中的-1价变为反应后Cl2中的0价,化合价升高,失去2个电子,电子得失最小公倍数是10,所以KMnO4、MnCl2前的系数是2,HCl前的系数是10,Cl2前的系数是5,根据原子守恒,KCl的系数是2,这样反应中有6个Cl原子未参加氧化还原反应,所有Cl原子都是由HCl提供,因此HCl前的系数为10+6=16,结合H原子反应前后相等,可知H2O的系数是8,用“双线桥”表示电子转移为: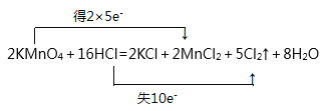 ;
;
(2)在标准状态下, 2.24LCl2的物质的量n(Cl2)=![]() =0.1mol。
=0.1mol。
①根据反应的化学方程式可知:生成0.1molCl2时,参与反应的KMnO4的物质的量为0.1mol×![]() =0.04mol,则参与反应的KMnO4的质量m(KMnO4)=0.04mol×158g/mol=6.32g;
=0.04mol,则参与反应的KMnO4的质量m(KMnO4)=0.04mol×158g/mol=6.32g;
②由反应化学方程式可知,HCl被氧化后生成Cl2,因此根据Cl元素守恒可知:被氧化的HCl的物质的量n(HCl)氧化=0.1mol×2=0.2mol。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:
【题目】由A和C为原料合成治疗多发性硬化症药物H的路线如下:
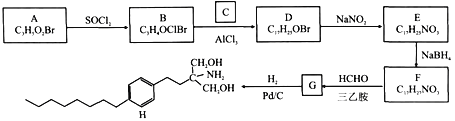
已知:
①A能与NaHCO3溶液反应放出CO2,其核磁共振氢谱显示有三组峰,峰面积比为2:2:1。
②NaBH4能选择性还原醛、酮,而不还原—NO2。

回答下列问题:
(1)A的化学名称为________,D的结构简式为_______。
(2)H的分子式为_______,E中官能团的名称为_______。
(3)B→D、E→F的反应类型分别为_______。
(4)F→G的化学方程式为________。
(5)与C互为同分异构体的有机物的结构简式为_______(核磁共振氢谱为四组峰,峰面积比为6:3:1:1)。
(6)设计由B和![]() 为原料制备具有抗肿瘤活性药物
为原料制备具有抗肿瘤活性药物 的合成路线__________。
的合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展“碳一化学”,开发利用我国丰富的煤炭资源具有重要的战略意义和经济价值。请回答下列问题:
(1)已知:常温下C(s)的燃烧热△H=-393.5 kJ·mol-1, S(s)的燃娆热△H=-296.0 kJ·mol-l ,CO2(g)+C(S)=2CO(g) △H=+172.5 kJ·mol-1,写出一氧化碳将二氧化硫还原为单质硫的热化学方程式:______
(2)在763 K、3.04×104 kPa时,用CO和H2做原料合成甲醇(CH3OH),存在下列平衡:CO(g)+2H2(g) ![]() CH3OH(g)。当原料中CO和H2的比例不同时,对CO的转化率及平衡混合物中甲醇的体积分数都有影响。
CH3OH(g)。当原料中CO和H2的比例不同时,对CO的转化率及平衡混合物中甲醇的体积分数都有影响。
①设H2和CO起始物质的量之比为m,平衡时CO的转化率为α,平衡混合物中甲醇的体积分数为y,则m、α、y三者的关系式为y=___。
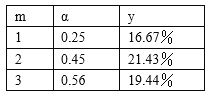
②根据表中提供的数据,可得出反应物的比例对CO的平衡转化率以及平衡混合物中甲醇的体积分数影响的结论,选择最佳反应物配比m=_______(填“l”、“2”或“3”),理由是_________。
(3)如图是四种金属氧化物被一氧化碳还原,反应达到平衡时lgc(CO)/c(CO2)与温度(T)的关系曲线图:

①8000C时,其中最易被还原的金属氧化物是______(填化学式),该反应的平衡常数K=_______。
②CO2还原PbO2的反应△H ___0(填“>”或“<”)。判断依据是_________。
(4)科学家正在研究用固态物质作为火箭推进剂。固体推进剂(硝酸钾和蔗糖的混合物)点燃后在燃烧室里燃烧,发生反应KNO3+C12H22O11→CO2↑+N2↑+H2O+K2CO3,(未配平)。则该反应中氧化剂与还原剂的物质的量之比是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在浓度都为1 mol·L-1的(NH4)2SO4、NH4H CO3、NH4HSO4、NH4Cl的四种溶液中,测得c(NH4+)分别为a、b、c、d(单位为mol·L-1)。下列判断正确的是
A. a=2b=2c=2d B. a>b>c> d C. a>c>d>b D. a>c>b>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.则下列说法中不正确的是

A.还原性:I->Fe2+>Br-
B.原混合溶液中FeBr2的物质的量为3mol
C.线段AB表示Fe2+被氯气氧化
D.原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
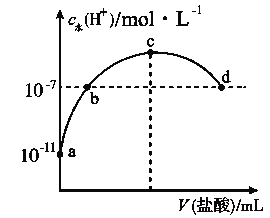
A. 常温下,0.1 mol·L-1氨水中![]() 的电离常数
的电离常数![]() 约为
约为![]()
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)<c(Cl-)
D. b点代表溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下各种说法:
①金属和非金属化合时一定形成离子键;
②离子键是阳离子、阴离子的相互吸引力;
③根据电离方程式HCl![]() H++Cl-,判断氯化氢分子里存在离子键;
H++Cl-,判断氯化氢分子里存在离子键;
④氢气和氯气的反应过程:H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程
上述各种说法正确的是
A. ①② B. 都不正确 C. ①②④ D. ①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一种同位素X的原子质量数为A,含N个中子,它与![]() 原子组成HmX分子.在a克HmX中所含质子的物质的量是( )
原子组成HmX分子.在a克HmX中所含质子的物质的量是( )
A. ![]() (A-N+m)molB.
(A-N+m)molB. ![]() (A-N)molC.
(A-N)molC. ![]() (A-N)molD.
(A-N)molD. ![]() (A-N+m)mol
(A-N+m)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为_____________。
(2)由A、B、W三种元素组成的18电子微粒的电子式为______________。
(3)若要比较D与E的金属性强弱,下列实验方法可行的是____________。
A. 将单质D置于E的盐溶液中,若D不能置换出单质E,说明D的金属性弱
B. 比较D和E的最高价氧化物对应水化物的碱性,前者比后者强,故前者金属性强
C. 将D、E的单质分别投入到同浓度的盐酸中,观察到D反应更剧烈,说明D的金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com