

 ;
;分析 根据各元素在周期表中的相对位置可知,A为H、D为C、F为O、G为Mg、Q为Al、M为S、R为Cl、N为K,
(1)离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小;
(2)N为K元素,其最高价氧化物对应的水化物为氢氧化钾,氢氧化钾中既含有离子键,也含有共价键;
(3)M为S、R为Cl,非金属性越强,最高价氧化物对应的水化物的酸性越强,或非金属对应的氢化物稳定性越强;
(4)该化合物为氯化镁,氯化镁为离子化合物,由离子形成离子键;
(5)A为H、D为C,二者形成的最简单的有机物为甲烷,甲烷为正四面体结构;
(6)C、H元素组成的有机物为烃,X不能使酸性高锰酸钾溶液褪色,说明分子中不含碳碳双键或三键,将X滴入溴水中混合液分层,发生了萃取现象;
(7)A单质为氢气,氢气与空气中氧气在强碱性溶液中形成燃料电池,负极氢气生成电子在酸性溶液中生成水,据此写出电极反应式.
解答 解:根据各元素在周期表中的相对位置可知,A为H、D为C、F为O、G为Mg、Q为Al、M为S、R为Cl、N为K,
(1)F为O、G为Mg、Q为Al,三种元素形成的离子的电子层数相同,铝离子的核电荷数最大,则Al3+的离子半径最小,
故答案为:Al3+;
(2)N为K元素,K的最高价氧化物对应的水化物为KOH,KOH中既含有离子键,也含有共价键,
故答案为:离子键、共价键(极性键);
(3)M为S、R为Cl,比较元素的非金属性强弱,可根据最高价氧化物对应水化物的酸性或对应的氢化物的稳定性,非金属性Cl>S,则酸性:HClO4>H2SO4,稳定性:HCl>H2S,
故答案为:酸性为HClO4>H2SO4(或稳定性为HCl>H2S);
(4)G为Mg、R为Cl,二者形成的化合物为氯化镁,氯化镁属于离子化合物,用电子式表示其形成过程为: ,
,
故答案为: ;
;
(5)A为H、D为C,二者形成的最简单的有机物为甲烷,甲烷分子为正四面体结构,
故答案为:正四面体;
(6)该有机物不能使酸性高锰酸钾溶液褪色,说明与溴水发生的是萃取现象,由于烃的密度小于水,则混合液分层:液体分为两层,上层为溶有溴单质的有机层,混合液呈橙色,下层为水层,几乎为无色,
故答案为:液体分为两层,上层呈橙色,下层几乎为无色;
(7)碱性氢氧燃料电池中,氢气在负极失电子生成水,其负极的电极反应式为:H2-2e-+2OH-═2H2O,
故答案为:H2-2e-+2OH-═2H2O.
点评 本题考查了元素周期表、元素周期律的综合应用,题目难度中等,熟练掌握元素周期表结构、元素周期律的内容为解答关键,试题涉及的知识点较多、综合性较强,充分考查学生的分析能力及灵活应用基础知识的能力.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 大于20 mL | B. | 小于20 mL | C. | 等于20mL | D. | 等于5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的最高价氧化物的熔点比X的最高价氧化物的熔点低 | |
| B. | 原子半径:Y>Z>X | |
| C. | Y的最高价氧化物的水化物只能与酸反应,不能与碱反应 | |
| D. | 由Z、Y两元素分别形成的单质均存在同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为190kJ/mol | |
| B. | 该反应说明CH3OH比H2稳定 | |
| C. | 反应中的能量变化与反应体系的温度和压强无关 | |
| D. | CO2(g)+2H2(g)→CH3OH(g)+$\frac{1}{2}$O2(g),△H=-190kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业冶炼铁Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | |
| B. | 火法炼铜Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | |
| C. | 工业冶炼镁MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2 | |
| D. | 工业冶炼铝Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从氟到碘,单质的氧化性逐渐减弱,氢化物的还原性逐渐增强 | |
| B. | 从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| C. | 等物质的量的钠原子比铝原子失去的电子数少,所以钠比铝的还原性弱 | |
| D. | 氧和硫为同主族元素,氧比硫的原子半径小,氧气比硫的氧化性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
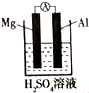 (普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系)
(普)实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系) | 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | D.不十分剧烈,产生无色气体 |
| ⑤向AlCl3溶液中滴加NaOH溶液至过量 | E.生成白色胶装沉淀,继而沉淀消失 |
| 实验内容 | ① | ② | ③ | ④ | ⑤ |
| 实验现象(填A-E) | B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
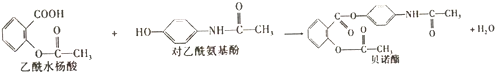
| A. | 根据有机物的分类,乙酰水杨酸也属于芳香烃 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| D. | 1mol乙酰水杨酸最多能与2molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com