
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 | |
| 实验1 | 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 实验2 | 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 实验3 | 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
分析 (1)铝能置换出酸中的氢;
(2)温度越高反应速率越快,金属和酸的反应是放热反应;
(3)1.5mol/L的硫酸中氢离子浓度与3mol/L的盐酸中氢离子浓度相同,铝与酸反应的实质是铝与氢离子的反应,从而得出硫酸根与氯离子在反应中起到不同的作用;
(4)利用固定变量法探究氯离子和硫酸根离子对金属铝表面的氧化膜与H+反应的影响.
解答 解:(1)铝能置换出酸中氢离子,离子方程式为:2Al+6H+═2Al3++3H2↑,
故答案为:2Al+6H+═2Al3++3H2↑;
(2)反应1~15min内,铝与酸的反应是放出热量的,导致温度升高,使化学反应速率加快,
故答案为:反应放出热量,温度升高,使化学反应速率加快;
(3)1.5mol/L的硫酸中氢离子浓度与3mol/L的盐酸中氢离子浓度相同,铝与酸反应的实质是铝与氢离子的反应,在反应的条件中,只有阴离子不同,从反应现象得出硫酸根与氯离子在反应中起到不同的作用,将实验2中硫酸的浓度设计为1.5mol/L的依据是统一氢离子的浓度,比较阴离子在反应中的不同作用,
故答案为:统一氢离子的浓度,比较阴离子在反应中的不同作用;
(4)在铝的表面有一层致密氧化铝薄膜,当加入盐酸和硫酸溶时,酸液首先与氧化铝薄膜反应,由反应的现象可知,铝片和稀盐酸反应现象明显,而和稀硫酸几乎不反应,比较盐酸和硫酸溶液中含有的离子的不同,出现这种现象的原因可能是:氯离子促进金属铝表面的氧化膜与H+反应,硫酸根离子对金属铝表面的氧化膜与H+反应对起阻碍作用,所以假设一:促进金属铝表面的氧化膜与H+反应;假设二:对金属铝表面的氧化膜与H+反应起阻碍作用,
故答案为:促进金属铝表面的氧化膜与H+反应;对金属铝表面的氧化膜与H+反应起阻碍作用.
点评 本题探究影响化学反应速率的因素,考查除浓度、温度等常考条件外的其他条件,题目新颖,特别注意利用控制变量法设计实验论证假设.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.
有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用AgNO3溶液可以鉴别KCl和KI | |
| B. | SO2使溴水褪色与乙烯使KMnO4溶液褪色原理相同 | |
| C. | 可根据硫酸密度的大小判断铅蓄电池是否需要充电 | |
| D. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
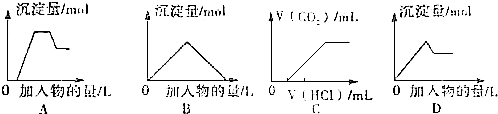
| A. | 图A表示想含OH-、AlO2-、CO32-、SiO32-、的溶液中滴加HCL溶液产生沉淀量的关系曲线 | |
| B. | 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线 | |
| C. | 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线 | |
| D. | 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥①②⑤④ | B. | ⑤①②⑥④③ | C. | ⑤④③②①⑥ | D. | ③①②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com