
»ÆѧŹĒŅŌŹµŃéĪŖ»ł“”µÄ”£ĄūÓĆŅŃѧÖŖŹ¶¶ŌĻĀĮŠŹµŃé½ųŠŠ·ÖĪö²¢ĢīæÕ£ŗ
¢ń£®£Ø8·Ö£© Ä³ŃŠ¾æŠŌѧĻ°Š”×éÉč¼ĘĮĖŅ»×鏵Ń饓Ģ½¾æŌŖĖŲÖÜĘŚĀÉ”£
¼×Ķ¬Ń§øł¾ŻŌŖĖŲ·Ē½šŹōŠŌÓė¶ŌÓ¦×īøß¼Ūŗ¬ŃõĖįÖ®¼äµÄ¹ŲĻµ£¬Éč¼ĘĮĖČēĶ¼1×°ÖĆĶź³ÉĶ¬Ö÷×åŌŖĖŲ·Ē½šŹōŠŌĒæČõ±Č½ĻµÄŹµŃéŃŠ¾æ£»
ŅŅĶ¬Ń§Éč¼ĘĮĖČēĶ¼2×°ÖĆŹµŃ饓ŃéÖ¤Ā±×åŌŖĖŲŠŌÖŹµÄµŻ±ä¹ęĀɣؼŠ³Ö×°ÖĆŅŃĀŌČ„£©”£A”¢B”¢CČżøö½ŗĶ·µĪ¹Ü·Ö±šŹĒĀČĖį¼ŲČÜŅŗ”¢NaBrČÜŅŗ”¢µķ·ŪKIČÜŅŗ”£ŅŃÖŖ³£ĪĀĻĀÅØŃĪĖįÓėĀČĖį¼ŲČÜŅŗÄÜ·“Ӧɜ³ÉĀČĘų”£
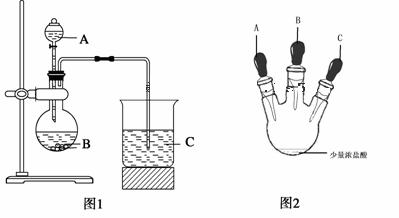
£Ø1£©¼×Ķ¬Ń§Éč¼ĘŹµŃéĖłÉę¼°µÄĄė×Ó·½³ĢŹ½ĪŖ ”¢
£»
£Ø2£©ŅŅĶ¬Ń§¾ßĢå²Ł×÷ČēĻĀ£ŗ
¢ŁĻČ¼·Ń¹½ŗĢåµĪ¹ÜA£¬Ź¹ÉŁĮæČÜŅŗµĪČėÉÕĘæÄŚ£»
¢Ś¼·Ń¹ĢåµĪ¹ÜB£¬Ź¹ÉŌ¹żĮæČÜŅŗµĪČėÉÕĘæÄŚ£¬³ä·Ö·“Ó¦”£Š“³öøĆ²Ł×÷ÖŠÖ÷ŅŖĄė×Ó·½³ĢŹ½ĪŖ ”£
¢ŪŌŁ¼·Ń¹ĢåµĪ¹ÜC£¬Ź¹ÉŁĮæČÜŅŗµĪČėÉÕĘæÄŚ£¬æɹŪ²ģµ½ £»
£Ø3£©øł¾Ż¼×ŅŅĶ¬Ń§µÄŹµŃéæɵƵ½µÄ½įĀŪŹĒ£ŗ ”£
II£®(6·Ö)
| ŹµŃéÄæµÄ |
| ||
| ŹµŃé |
|
|
|
| ŹµŃé½įĀŪ | ½įĀŪ£ŗ FeCl3ŌŚŹµŃéÖŠµÄ×÷ÓĆĪŖ£ŗ | ||
| ·“Ó¦·½³ĢŹ½ |
|
”¾ÖŖŹ¶µć”æĀČ”¢ä唢µā¼°Ęä»ÆŗĻĪļµÄ×ŪŗĻŌĖÓĆ£¬Ķā½ēŅņĖŲ¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ
”¾“š°ø½āĪö”æ¢ń£Ø8·Ö£©£Ø1£©2H+ +CaCO3 =Ca2+ + CO2”ü + H2O
SiO32- + CO2”ü + H2O =H2SiO3”ż +CO32-
£Ø2£©¢Ś Cl2 + 2Br- =2Cl- +Br2 £ØŅŌÉĻø÷2·Ö£©¢ŪČÜŅŗŃÕÉ«Óɻʱ䥶£Ø1·Ö£©
£Ø3£©Ķ¬Ņ»Ö÷×壬“ÓÉĻµ½ĻĀ£¬ŌŖĖŲ·Ē½šŹōŠŌ¼õČõ£Ø1·Ö£©
¢ņ£Ø6·Ö£©
| ŹµŃéÄæµÄ£ŗĢ½¾æĪĀ¶Č¶ŌH2O2·Ö½ā·“Ó¦ĖŁĀŹµÄÓ°Ļģ£Ø2·Ö£© |
| ĪĀ¶ČŌ½øߣ¬»Æѧ·“Ó¦ĖŁĀŹŌ½æģ £Ø1·Ö£© “߻ƼĮ £Ø»ņ¼Óæģ·“Ó¦ĖŁĀŹ£©£Ø1·Ö£© |
| 2H2O2 |


 ŹĄ¼Ķ°ŁĶØĘŚÄ©½š¾ķĻµĮŠ“š°ø
ŹĄ¼Ķ°ŁĶØĘŚÄ©½š¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚĻĀĮŠøų¶ØĢõ¼žµÄø÷ČÜŅŗÖŠ£¬Ņ»¶ØÄÜ“óĮæ¹²“ęµÄĄė×Ó×éŹĒ( )
A.ŗ¬ÓŠ0.1 mol”¤L-1 Fe3+µÄČÜŅŗÖŠ£ŗK+”¢Mg2+”¢SCN-”¢NO3-
B.ŹŅĪĀĻĀ =10-13 mol”¤L-1µÄČÜŅŗÖŠ£ŗNH4+”¢Mg2+”¢NO3-”¢SO42-
=10-13 mol”¤L-1µÄČÜŅŗÖŠ£ŗNH4+”¢Mg2+”¢NO3-”¢SO42-
C.¼ÓČėAlÄܷųöH2µÄČÜŅŗÖŠ£ŗNH4+”¢K+”¢Cl-”¢HCO3-
D.ŌŚH+”¢Na+”¢SO42-ÅØ¶Č¾łĪŖ0.1 mol”¤L-1µÄČÜŅŗÖŠ£ŗK+”¢SiO32-”¢Cl-”¢CH3COO-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ć¾ŹĒŅ»ÖÖÖŲŅŖµÄ½šŹō׏Ō“£¬¹¤ŅµÉĻÖĘČ”Ć¾µ„ÖŹÖ÷ŅŖŹĒµē½ā·Ø”£
£Ø1£©µē½ā·ØÖĘČ”Ć¾µ„ÖŹµÄ·“Ó¦·½³ĢŹ½ŹĒ£ŗ______________________________”£
£Ø2£©µē½āŌĮĻĪŽĖ®ĀČ»ÆĆ¾æÉÓÉŗ£Ė®Öʱø”£Ö÷ŅŖÓŠŅŌĻĀ²½Öč£ŗ¢ŁŌŚŅ»¶ØĢõ¼žĻĀĶŃĖ®øÉŌļ£»¢Ś¼ÓŹģŹÆ»Ņ£»¢Ū¼ÓŃĪĖį£»¢Ü¹żĀĖ£»¢ŻÅØĖõĄäČ“½į¾§”£
Ęä²½ÖčĻČŗóĖ³ŠņŹĒ__________________________________£»£ØĆæ²½ÖčæÉÖŲø“Ź¹ÓĆ£©
£Ø3£©ÉĻŹö²½Öč¢ŁÖŠ”°Ņ»¶ØĢõ¼žĻĀ”±¾ßĢåŹĒÖø£ŗ_______________________________£¬ĘäÄæµÄŹĒ___________________________________________”£
£Ø4£©ŅŃÖŖijĪĀ¶ČĻĀMg(OH)2µÄKsp£½6.4”Įl0−12£¬µ±ČÜŅŗÖŠc(Mg2+)”Ü1.0”Į10−5mol”¤L−1æÉŹÓĪŖ³ĮµķĶźČ«£¬Ōņ“ĖĪĀ¶ČĻĀÓ¦±£³ÖČÜŅŗÖŠc(OH£)”Ż_________________ mol”¤L−1”£
£Ø5£©±„ŗĶNH4ClČÜŅŗµĪČėÉŁĮæµÄMg(OH)2Šü×ĒŅŗÖŠ£¬æ“µ½µÄĻÖĻóŹĒ___________”£·“Ó¦ŌĄķæÉÄÜÓŠĮ½·½Ćę£¬Ēė·Ö±šÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£ŗ
¢Ł________________________________________________£»
¢Ś________________________________________________”£
ŅŖŃéÖ¤¢Ł¢ŚĖŹĒMg(OH)2ČܽāµÄÖ÷ŅŖŌŅņ£¬æÉєȔ________“śĢęNH4ClČÜŅŗ×÷¶ŌÕÕŹµŃ锣
A£®NH4NO3 B£®(NH4)2SO4 C£®CH3COONH4 D£®NH4HCO3
£Ø6£©Ć¾µē³ŲŹĒ½üÄźĄ“æĘѧ¼¼ŹõŃŠ¾æµÄČȵćÖ®Ņ»”£Ņ»ÖÖ”°Ć¾”Ŗ“ĪĀČĖįŃĪ”±µē³ŲµÄ×Ü·“Ó¦ĪŖ£ŗ
Mg + ClO- + H2O == Mg(OH)2 + Cl- ”£Ę乤×÷Ź±Õż¼«µÄµē¼«·“Ó¦Ź½£ŗ_________________£»ÓĆ“ĖĆ¾µē³ŲøųĒ¦Šīµē³Ų³äµē£¬ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ______________________________”£
A£®Ć¾µē³ŲÕż¼«ÓėĒ¦Šīµē³ŲÕż¼«ĻąĮ¬
B£®µē×Ó“ÓPbµē¼«×ŖŅʵ½Ć¾µē³Ųøŗ¼«
C£®³äµēŗó£¬Ē¦Šīµē³ŲĮ½¼«ÖŹĮæ¾ł¼õŠ”£¬ĄķĀŪÉĻĆ¾µē³ŲĻūŗÄ24 g Mg£¬Ņõ”¢Ńō¼«µÄÖŹĮæ±ä»ÆÖ®±ČĪŖ3©U2
D£®³äµēŗó£¬Ć¾µē³ŲŗĶĒ¦Šīµē³ŲµÄpH¾łŌö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijĪĀ¶ČĻĀ£¬ÅØ¶Č¶¼ŹĒ1 mol/LµÄĮ½ÖÖĘųĢåX2ŗĶY2£¬ŌŚĆܱÕČŻĘ÷ÖŠ·“Ӧɜ³ÉZ£¬·“Ó¦2minŗ󣬲āµĆ²Ī¼Ó·“Ó¦µÄX2ĪŖ0.6mol/L£¬ÓĆY2±ä»Æ±ķŹ¾µÄ·“Ó¦ĖŁĀŹv(Y2)= 0.1mol/£ØL ”¤ min£©£¬Éś³ÉµÄc(Z)= 0.4 mol/L,ŌņøĆ·“Ó¦·½³ĢŹ½ĪŖ
A£®3X2+Y2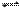 2X3Y B£®2X2+Y2
2X3Y B£®2X2+Y2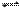 2X2Y
2X2Y
C£® X2+2 Y2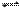 2XY2 D£®X2+3Y2
2XY2 D£®X2+3Y2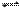 2XY3
2XY3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠ·“Ó¦¼ČŹĒŃõ»Æ»¹Ō·“Ó¦£¬ÓÖŹĒĪüČČ·“Ó¦µÄŹĒ£Ø £©
A£®ĀĮʬŗĶĻ”ĮņĖį·“Ó¦ B£®Ba£ØOH£©2•8H2OÓėNH4Cl·“Ó¦
C£®×ĘČȵÄĢæÓėCO2·“Ó¦ D£®¼×ĶéŌŚO2ÖŠČ¼ÉÕ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÄÜÕżČ·±ķŹ¾ĻĀĮŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½µÄŹĒ£Ø £©
A.×ćĮæµÄĮņĖįĀĮČÜŅŗÓė“æ¼īČÜŅŗ·“Ó¦: 2A13++3CO32-+3H2O =2A1(OH)3”ż+3CO2”ü
B. NaHSČÜŅŗµÄĖ®½ā·½³ĢŹ½: HS-+H2O H3O++S2-
H3O++S2-
C. Fe(OH)3Óė×ćĮæµÄHIČÜŅŗ·“Ó¦: Fe(OH)3+3H+=Fe3++3H2O
D.ĻņŃĒĮņĖįĒāļ§ČÜŅŗÖŠ¼ÓČė×ćĮæµÄNaOHČÜŅŗ: NH4++OH-=NH3”¤H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½«ĀČ»ÆĀĮČÜŅŗŗĶĒāŃõ»ÆÄĘČÜŅŗµČĢå»ż»ģŗĻ,µĆµ½µÄ³ĮµķĪļÖŠŗ¬ĀĮŌŖĖŲµÄÖŹĮæÓėČÜŅŗÖŠŗ¬ĀĮŌŖĖŲµÄÖŹĮæĻąµČ,ŌņŌĀČ»ÆĀĮČÜŅŗŗĶĒāŃõ»ÆÄĘČÜŅŗµÄĪļÖŹµÄĮæÅضČÖ®±ČæÉÄÜŹĒ( )
¢Ł1”Ć3 ¢Ś2”Ć3 ¢Ū1”Ć7 ¢Ü2”Ć7 ¢ŻČĪŅā±Č
A£® ¢Ż B£®Ö»ÓŠ¢Ł C£®¢Ś ¢Ü D£®¢Ł ¢Ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£Źż£¬ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ
A.1 mol Cl2Óė×ćĮ潚ŹōĀĮ·“Ó¦£¬×ŖŅʵĵē×ÓŹżĪŖ3NA
B.±ź×¼×“æöĻĀ£¬11.2 Lŗ¤ĘųÖŠŌ¼ŗ¬ÓŠNAøöŗ¤Ō×Ó
C.½«NAøöNH3·Ö×ÓČÜÓŚ1 LĖ®ÖŠµĆµ½1 mol”¤L£1µÄ°±Ė®
D.³£ĪĀĻĀ32 gŗ¬ÓŠÉŁĮæ³ōŃõµÄŃõĘųÖŠ£¬¹²ŗ¬ÓŠ2 NAøöŃõŌ×Ó(ŃõµÄĻą¶ŌŌ×ÓÖŹĮæ£ŗ16)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
1.0 gĆ¾ŌŚŃõĘųÖŠČ¼ÉÕŗóŌöÖŲ0.64 g£¬µ«ŌŚæÕĘųÖŠČ¼ÉÕŹ±ŌöÖŲ²»×ć0.64 g£¬ĘäŌŅņæÉÄÜŹĒ
A£®æÕĘųÖŠĆ¾Č¼ÉÕæĻ¶Ø²»ĶźČ« B£®æÕĘųÖŠ²æ·ÖĆ¾ÓėCO2·“Ó¦
C£®æÕĘųÖŠĆ¾²æ·ÖÓėN2·“Ó¦ D£®æÕĘųÖŠĆ¾²æ·ÖÓėĖ®ÕōĘų·“Ó¦
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com