
| A. | ①③⑥ | B. | ①④⑤ | C. | ①③④ | D. | ①③⑤⑥ |
分析 氯水中的氯气具有强氧化性,会把一些还原气体氧化,氯水中含有氯离子会与硝酸银发生反应生成氯化银沉淀,钡离子与硫酸根反应生成难溶于水的硫酸钡沉淀,据此判断即可.
解答 解:氯水具有强氧化性,气体通入氯水中,得无色透明溶液,说明气体中无还原性气体H2S、HBr,否则溶液中会有沉淀或溶液有色.加盐酸酸化的BaCl2溶液有白色沉淀,说明有白色BaSO4沉淀生成,原混合气体中一定有SO2气体,被氯水氧化成硫酸,化学反应方程式为:SO2+Cl2+2H2O═2HCl+H2SO4;另一份加硝酸酸化的AgNO3,有白色沉淀AgCl,但因是气体通入氯水形成的溶液,氯水中本有Cl-,不能以此确定HCl气体的存在,CO2在整个过程中无现象,故无法确定.
故一定有:SO2,一定没有:H2S、HBr,无法确定HCl的二氧化碳的存在,
故选C.
点评 本题主要考查的是常见气体和离子的性质以及检验,要注意加入试剂可能含有待检验的成分,故不能确定此气体的存在,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 放出218 kJ | B. | 放出109kJ | C. | 吸收218 kJ | D. | 吸收109 kJ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤正确 | B. | 都不正确 | ||
| C. | ④正确,其他不正确 | D. | 仅①不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、O2、SO2 | B. | CO2、H2S、Cl2 | C. | HCl、HBr、HI | D. | NH3、HCl、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
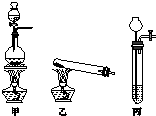 相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略).
相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com