
以下是25 ℃时几种难溶电解质的溶解度:
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤,结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤,结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为________(填名称)而除去。
(2)①中加入的试剂应选择________为宜,其原因是_________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为_______________________
_________________________________________________________________。
(4)下列关于方案③相关的叙述中,正确的是________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
解析 ①中为了不引入杂质离子,应加入氨水使Fe3+沉淀,而不能用NaOH溶液。②中根据溶解度表可知Mg(OH)2易转化为Fe(OH)3,因此在MgCl2溶液中加入足量Mg(OH)2使Fe3+转化为Fe(OH)3沉淀,然后将沉淀一并过滤。③中利用Fe3+极易水解的特点,据题意可知调节溶液的pH=4可使Fe3+沉淀完全,为了不引入杂质离子,氧化Fe2+可用绿色氧化剂H2O2,调节pH可使用CuO、Cu(OH)2、CuCO3等。
答案 (1)氢氧化铁 (2)氨水 不会引入新的杂质
(3)2Fe3+(aq)+3Mg(OH)2(s)===3Mg2+(aq)+2Fe(OH)3(s) (4)ACDE


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则按系统命名法,异辛烷的名称为 ( )。
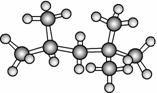
A.1,1,3,3-四甲基丁烷 B.2,2,4-三甲基-戊烷
C.2,4,4-三甲基戊烷 D.2,2,4-三甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
已知苯在一定条件下可发生烷基化取代反应:

①________________________________________________________________________,
②________________________________________________________________________,
③________________________________________________________________________,
④________________________________________________________________________,
⑤________________________________________________________________________,
⑥________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS-、S2-的分布分数(平衡时某物质的浓度占各物质浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程中H2S气体的逸出)。
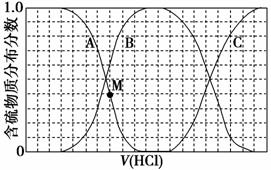
(1)B表示__________________。
(2)滴加稀盐酸至过量的过程中,溶液中微粒浓度的大小关系正确的是________(填字母)。
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
(3)NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×
10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法正确的是 ( )。
A.25 ℃时,0.1 mol·L-1 HF溶液的pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中,Ksp(CaF2)=
D.该体系中有CaF2沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于合成氨工业的叙述可用勒夏特列原理来解释的是 ( )。
A.使用铁触媒,使平衡向生成NH3的方向移动
B.高压比常压条件更有利于合成氨的反应
C.500 ℃左右比室温更有利于合成氨的反应
D.合成氨时采用循环操作可提高原料的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________。
A.采用较高压强(20~50 MPa)
B.采用500 ℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,剩余N2和H2循环到合成塔
中,并补充N2和H2
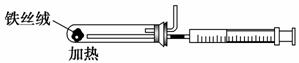
(2)下图是实验室模拟工业合成氨的简易装置,简述检验有氨气生成的方法:
_________________________________________________________________。
(3)在298 K时,将10 mol N2和30 mol H2通入合成塔中,放出的热量小于924
kJ,原因是_________________________________________________________
_________________________________________________________________。
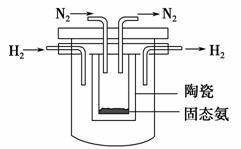
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性
的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电化学合成氨。其
实验装置如下图,则其阴极的电极反应式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
按照阿伏加德罗定律,下列叙述不正确的( )
A.同温同压下两种气体的体积之比等于物质的量之比
B.同温同压下两种气体的物质的量之比等于密度之比
C.同温同压下两种气体的密度之比等于摩尔质量之比
D.同温同体积下两种气体的物质的量之比等于压强之比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com