
分析 ①A.盐是由阳离子和酸根离子形成的化合物;
B.糖类是多羟基醛或多羟基酮及其缩聚物和某些衍生物的总称;
C.不含碳元素的化合物叫无机化合物,部分含有碳但性质与无机物相似属于无机物;
D.含碳元素的化合物叫有机化合物,部分含有碳但性质与无机物相似属于无机物;
②熟石灰的成分是氢氧化钙,能中和酸性废水;
③根据方程式①②③判断氟氯代烷能破坏大量臭氧的原因.
解答 解:①A.盐是由阳离子和酸根离子形成的化合物,塑料袋属于有机合成材料,废纸的主要成分是植物的纤维是纤维素,不属于盐类,故A错误;
B.塑料袋属于有机合成材料,废纸的主要成分是植物的纤维是纤维素,不属于糖类,故B错误;
C.生活中废弃的塑料袋、废纸,都是含碳元素的化合物,不属于无机物,故C错误;
D.生活中废弃的塑料袋、废纸,都是含碳元素的化合物,属于有机化合物,故D正确.
故答案为:D;
②熟石灰的成分是氢氧化钙,能中和酸性废水,化学方程式为Ca(OH)2+2HCl=CaCl2+H2O,
故答案为:中和酸性物质;
③由①Cl+O3→ClO+O2、②O3→O+O2、③ClO+O→Cl+O2,可知氟氯代烷受紫外线的照射分解出氯原子,Cl+O3→ClO+O2,Cl对O3的分解有促进作用,所以Cl原子在整个反应过程中起了催化剂作用,加速臭氧的分解,
故答案为:氟氯代烷分解出Cl原子,Cl原子在整个反应过程中起了催化剂作用,加速臭氧的分解.
点评 本题考查环境保护等知识,为高频考点,涉及物质的分类、臭氧的破坏等,侧重于化学与生活、环境的考查,有利于培养学生的良好的科学素养,提高学习的积极性,题目难度不大.


科目:高中化学 来源: 题型:实验题
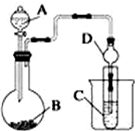 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
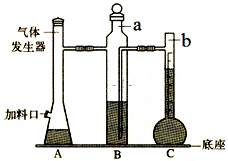 图是气体摩尔体积测定装置.
图是气体摩尔体积测定装置.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+、Cu2+、NO3-、OH- | B. | K+、Na+、Cl-、NO3- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | Fe3+、K+、NO3-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com