
【题目】某有机物的结构如图所示,有关该有机物的说法不正确的是

A. 该有机物的分子式为 C20H14O4
B. 该有机物分子中所有的原子不可能处于同一平面
C. 1mol 该有机物分别与 Br2、NaOH 反应, 最多能消耗 4molBr2、4molNaOH
D. 该有机物能发生加成、取代、氧化反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质的比较,正确的是
A.沸点:CH3(CH2)2CH3>(CH3)3CH
B.水中溶解性:C2H5Br>C2H5OH
C.密度:水>C2H5Br
D.碳碳键键长:乙炔>苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列单质或化合物性质的描述正确的是( )
A. NaHSO4水溶液显中性
B. SiO2与酸、碱均不反应
C. SiO2是酸性氧化物,能与NaOH溶液反应
D. Fe在足量Cl2中燃烧生成FeCl2和FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
(1)火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为____________________________。
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为_____________________________________________________。
(2)湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:

已知:PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq) + 2Cl-(aq) ![]() PbCl42-(aq)。不同温度下PbCl2的溶解度如下表所示:
PbCl42-(aq)。不同温度下PbCl2的溶解度如下表所示:
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解度(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
①浸取液中FeCl3的作用是________________________________。
②操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是___________________________________________________________________。
③将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

ⅰ.溶液3应置于_________ (填“阴极室”或“阳极室”)中。
ⅱ.简述滤液2电解后再生为FeCl3的原理______________________________________。
ⅲ.若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。

已知:i.R1CO18OR2+R3OH![]() R1COOR3+R218OH
R1COOR3+R218OH
ii. 
ⅲ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
(1)A的名称是_________;C的官能团的名称是_________。
(2)B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为_________ .
(3)E分子中含有两个酯基,且为顺式结构,E的结构简式为_________ .
(4)反应①的化学方程式为_________ 。
(5)试剂a的结构简式为_________;反应②所属的反应类型为________反应。
(6)已知:  。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成
。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成![]() 。将以下合成路线补充完整:_________________
。将以下合成路线补充完整:_________________

(7)已知氨基(-NH2)与羟基类似,也能发生反应i。在由J制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 100mL Na2CO3 与 NaAlO2 的混合溶液中逐滴加入 1mol/L 的盐酸,测得溶液中的 CO32-、HCO3- 、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。下列说法正确的是
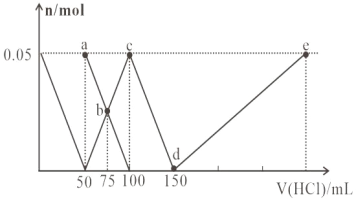
A. 原 混 合 溶 液 中 的 n (CO32-): n (AlO2-)=2:1
B. a 点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
C. b 点溶液中离子浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH- )
D. d→e 的过程中水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知:SOCl2+H2O![]() SO2↑+2HCl↑
SO2↑+2HCl↑
(1)“酸浸”时盐酸与CuCO3·Cu(OH)2反应的化学方程式为_________________。
检验“酸浸”后浸出液中的Fe3+可用____________溶液。
(2)“氧化”时发生反应的离子方程式为____________________________。
(3)“滤渣2”的主要成分为________(填化学式);“调pH”时,pH不能过高,其原因是________________。
(4)“加热脱水”时,加入SOCl2的目的是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com