
【题目】(I)SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如下图所示:
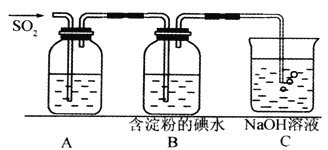
(1)若要从FeCl3溶液中提取晶体,在必须进行的实验操作步骤中,没有用到的玻璃仪器有________________(填字母)。
a.酒精灯 b.烧瓶 c.漏斗 d.烧杯 e.玻璃棒
(2)装置A中的现象是__________________,写出B中发生反应的离子方程式:__________________。
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下试验
方案①:向第一份溶液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:向第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案中不合理的是_______________(填序号)。
(Ⅱ)SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸。选择下面的装置和药品来探究亚硫酸与次氯酸的酸性强弱。
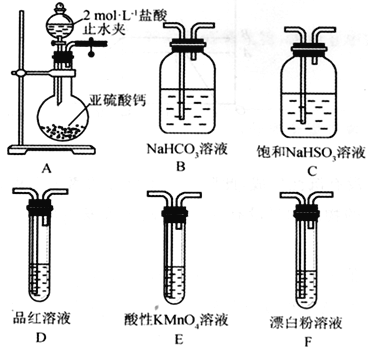
(4)装置正确的连接顺序为A、________________________________、D、F,其中装置B的作用是_________。证明亚硫酸的酸性强于次氯酸的现象为_____________________________。
(Ⅲ)某同学对SO2与漂粉精的反应进行了实验探究。
操作 | 现象 |
取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| ①溶液出现浑浊,并变为黄绿色 ②稍后,产生大量白色沉淀,黄绿色褪去 |
(5)C12和Ca(OH)2反应制取漂粉精的化学方程式是______________________________________。
(6)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________________________________。
(7)现象①中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分ClO-和Cl-发生反应。写出漂粉精在酸性条件下发生反应的离子方程式:_________________________________。
【答案】 b 溶液由黄色逐渐变为浅绿色 I2+SO2+2H2O=2I-+SO42-+4H+ ① C B E 制取CO2 D中品红溶液不褪色,F中出现白色沉淀 2Cl2+2Ca(OH)2==CaCl2 + Ca(CIO)2+2H2O 碱性、漂白性 ClO-+Cl-+2H+=H2O+Cl2↑
【解析】本题考查实验方案设计与评价,(I)(1)从FeCl3溶液中得到FeCl3晶体,为防止Fe3+水解,在加热时,需要在HCl的氛围中加热FeCl3溶液,得到FeCl3晶体,然后过滤,因此使用不到的仪器是烧瓶;(2)A中盛放含有Fe3+的溶液,利用Fe3+的氧化性把SO2氧化成SO42-,本身被还原成Fe2+,即溶液的颜色由棕黄色变为浅绿色;I2具有氧化性,能把SO2氧化成SO42-,本身被还原成I-,离子反应方程式为:I2+SO2+2H2O=2I-+SO42-+4H+;(3)方案①:因为通入过量的SO2,加入KMnO4溶液后,紫红色褪去,不能说明SO2与Fe3+发生氧化还原反应,故方案①不合理;方案②:加入KSCN溶液,溶液不变红,说明溶液中不含Fe3+,再加入氯水,溶液变红,说明溶液中含有Fe3+,从而推出SO2与Fe3+发生氧化还原反应,Fe3+被还原成Fe2+,故方案②合理;(II)(4)根据题目所给装置,先比较亚硫酸与碳酸酸性,然后利用碳酸的酸性强于次氯酸,从而作出推断,装置A作用是制取SO2,此装置中SO2含有HCl,HCl干扰实验,必须除去,制出的SO2通入到C装置,然后通入到装置B中,有气泡冒出,说明亚硫酸的酸性强于碳酸,此气体中混有SO2,然后用KMnO4溶液除去SO2,然后再通入品红溶液,检验SO2是否被完全除尽,品红不褪色,说明SO2被完全除尽,通入到F装置中,如果有白色沉淀产生,说明碳酸酸性强于次氯酸,从而得出结论,因此装置的连接顺序是A→C→B→E→D→F,装置B的作用是制取CO2,现象是D中品红溶液不褪色,F中出现白色沉淀;(III)(5)发生的反应是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;(6)pH试纸先变蓝,说明溶液显碱性,后褪色,说明溶液具有漂白性或强氧化性;(7)ClO-中Cl显+1价,Cl-显-1价,在酸性条件下发生:ClO-+Cl-+2H+=H2O+Cl2↑。


科目:高中化学 来源: 题型:
【题目】化学反应总是伴随能量变化,已知下列化学反应的焓变
①2HI(g)=H2(g)+I2(g)△H1
②SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)△H2
③H2SO4(l)=H2O(g)+SO2(g)+ ![]() O2(g)△H3
O2(g)△H3
④2H2O(g)=2H2(g)+O2(g)△H4
△H4与△H1、△H2、△H3之间的关系是:△H4= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从食品店购买的蔗糖配成溶液,做银镜反应实验,往往能得到银镜,产生这一现象的原因是 ( )
A.蔗糖本身有还原性
B.蔗糖被还原
C.实验过程中蔗糖发生水解
D.在生产和贮存过程中蔗糖有部分水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能说明影响化学反应速率的主要因素是反应物自身性质的是
A.Cu能与浓硝酸反应,但不能与浓盐酸反应
B.Fe与浓盐酸反应比与稀盐酸反应快
C.N2与O2在常温、常压下不反应,放电时可反应
D.Cu与浓硝酸反应比与稀硝酸反应快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
序号 | 氢氧化钠溶液的体积 | 盐酸的体积 | 溶液的pH |
① | 20.00 | 0.00 | 10 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A. 1 B. 4 C. 2 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 过量氯气通入溴化亚铁溶液:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2
B. 稀硝酸中加入过量铁粉:Fe+2H+=H2↑+Fe2+
C. 相等物质的量浓度氯化铁、氯化铜、盐酸的混合溶液中加入少量铁粉:Cu2++Fe =Fe2++Cu
D. 工业上电解熔融的氯化镁制金属镁:MgCl2 ![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学是一门中心学科,与社会、生活、科研密切的关系。”下列叙述中,不正确的是
A.大量使用燃煤发电是形成雾霾的主要原因
B.天然气、煤气大量泄漏遇到明火会爆炸
C.利用化学反应可实现12C到14C的转化
D.晶体硅可用于光伏发电、制造芯片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列说法不正确的是( )
A. 标准状况下,2.24L 1H2和0.4g2H2均含有0.2NA个质子
B. 惰性电极电解饱和食盐水,若电路中通过2NA个电子,则阳极产生气体22.4L
C. 常温常压下,23g NO2和N2O4的混合气体中含有的原子数为1.5NA
D. 1mol Na2CO3晶体中含有的CO32-数目一定为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com