
 水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题:
水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题:分析 (1)先计算出0.1 mol•L-1的NaOH中c(H+),再根据pH=-lg[H+]计算出溶液的pH;
(2)碳酸钠溶液中CO32-部分水解生成碳酸氢根和氢氧根离子,其水解方程式为:CO32-+H2O=HCO3-+OH-;pH=13的碳酸钠溶液中氢离子是由水电离产生的,水电离产生的c(H+)等于溶液中水电离出c(OH -),故水电离出c(OH -)=c(H+)=10-3mol/L;
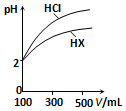
(3)由图可知,稀释相同倍数时HCl的pH变化大,则酸性HCl>HX.
解答 解:(1)纯水中的[H+]=[OH-],pH=6,[H+]=[OH-]=1×10-6mol•L-1,KW=1×10-6×1×10-6=1×10-12,0.1mol•L-1的NaOH溶液中氢氧根离子浓度为0.1mol/L,c(H+)=1×10-11mol•L-1,pH=-lg[H+]=11,故答案为:11;
(2)碳酸钠溶液中CO32-部分水解生成碳酸氢根和氢氧根离子,其水解方程式为:CO32-+H2O=HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,pH=13的碳酸钠溶液中氢离子是由水电离产生的,水电离产生的c(H+)等于溶液中水电离出c(OH -),故水电离出c(OH -)=c(H+)=10-3mol/L,
故答案为:CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-;10-3;
(3)由图可知,稀释相同倍数时HCl的pH变化大,则酸性HCl>HX,故HX为弱酸,存在电离平衡,
故答案为:弱酸; 稀释相同倍数,一元酸HX的pH变化量比HCl的小,说明HX存在电离平衡,故HX为弱酸.
点评 本题考查弱电解质的电离、溶液酸碱性和pH的计算判断,为高频考点,侧重考查学生的分析能力,综合性较强,注意把握pH的计算方法以及弱电解质的电离特点,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 | |
| B. | ①中Se是氧化产物,I2是还原产物 | |
| C. | 反应①中KI是氧化剂,SeO2是还原剂 | |
| D. | 反应①中每有1.0mol I2生成,转移电子数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OOH的物质的量 | |
| B. | 溶液中的n(H+) | |
| C. | 用同浓度的NaOH溶液恰好完全反砬,消耗NaOH溶液的体积 | |
| D. | 溶液的导电能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 在t℃时,Ag2CrO4的Ksp为1×10-8 | |
| B. | 在饱和溶液中加入K2CrO4可使溶液由Y点到Z点 | |
| C. | 在t℃时,Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107 | |
| D. | 在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,Cl-先沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 温度/℃ | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
| Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
| Ⅱ | 758 | 0.1 | 0.05 | 0 | |
| Ⅲ | 858 | 0.2 | 0.1 | 0 | |
| A. | 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol•L-1•s-1 | |
| B. | 平衡时,容器Ⅱ中SO3的浓度小于0.022 mol•L-1 | |
| C. | 平衡时,容器Ⅲ中SO3的浓度大于0.044 mol•L-1 | |
| D. | 若起始时,向容器Ⅰ中充入0.02 mol SO2,0.01 mol O2和0.02 mol SO3,则反应向逆反应方向进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com