
分析 硫酸、硝酸的混合溶液与过量的Fe反应生成NO、氢气,说明硝酸完全被还原生成NO,最终得到FeSO4溶液,根据n=cV计算H2SO4、HNO3物质的量,根据N元素守恒可知n(NO)=n(HNO3),根据硫酸根守恒可知n(FeSO4)=n(H2SO4),根据Fe元素守恒计算参加反应Fe的物质的量,再根据电子转移守恒计算氢气物质的量,根据V=nVm计算NO、氢气体积.
解答 解:硫酸、硝酸的混合溶液与过量的Fe反应生成NO、氢气,说明硝酸完全被还原生成NO,最终得到FeSO4溶液,
根据N元素守恒可知n(NO)=n(HNO3)=0.1L×2mol/L=0.2mol,故生成NO的体积=0.2mol×22.4L/mol=4.48L;
根据硫酸根守恒可知n(FeSO4)=n(H2SO4)=0.1L×4mol/L=0.4mol,根据Fe元素守恒,参加反应Fe的物质的量=n(FeSO4)=0.4mol,质量为0.4mol×56g/mol=22.4g,令生成氢气为x mol,根据电子转移守恒:2x+0.2×(5-2)=0.4×2,解得x=0.1,故生成氢气的体积=0.1mol×22.4L/mol=2.24L;
答:标况下,生成一氧化氮的体积为4.48L,生成氢气的体积为2.24L;消耗铁的质量为22.4g.
点评 本题考查混合物计算,判断发生的反应是解题关键,侧重对解题方法技巧与思维能力的考查,注意利用守恒思想进行解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CH3OH在负极上失去电子,O2在正极上得到电子 | |
| B. | 溶液中OH-向正极移动,H+向负极移动 | |
| C. | CH3OH发生还原反应,O2发生氧化反应 | |
| D. | 随着电极反应的不断进行,电解质溶液的pH值基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池中,物质在负极发生氧化反应 | |
| B. | 在原电池中,电子由正极流向负极 | |
| C. | 在电解池中,物质在阴极发生氧化反应 | |
| D. | 在电解池中,与电源正极相连的电极是阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ | |
| D. | 医学上了利用银镜反应来检验患者尿液中葡萄糖含量是否偏高 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:填空题
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 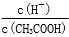 的比值将____________(填“增大”、“减小”或“无法确定”)。
的比值将____________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)___ _______pH(乙)(填“大于”、“小于”或“等于”,下同)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
已知反应A2(g)+2B2(g)  2AB2(g)△H<0,下列说法正确的是( )
2AB2(g)△H<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考一化学试卷(解析版) 题型:选择题
一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )
A.c1:c2=3:1
B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率相等
D.c1的取值范围为0.04 mol/L<c1<0.14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
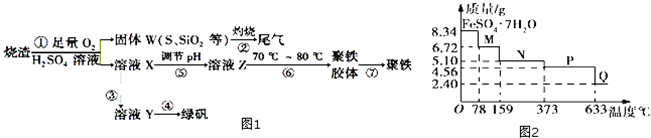
 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com