
| A. | ①③⑥③ | B. | ②③⑥③ | C. | ②③④③ | D. | ②③⑤③ |
分析 铝可与NaOH溶液反应生成NaAlO2,在反应后的溶液中加入弱酸,可通入过量CO2,生成Al(OH)3沉淀,经过滤、洗涤可得到纯净的氢氧化铝.但含有少量SiO2(酸性氧化物)的铝片,则先加盐酸溶解,SiO2不反应,过滤可除杂,Al与盐酸生成氯化铝,再与足量氨水反应可制取纯净的氢氧化铝,以此来解答.
解答 解:含有少量SiO2(酸性氧化物)的铝片,则先加盐酸溶解,SiO2不反应,过滤可除杂,Al与盐酸生成氯化铝,再与足量氨水反应,然后过滤可制取纯净的氢氧化铝,即操作顺序为①③⑥③,
故选A.
点评 本题考查物质的分离、提纯的实验方案的设计,为高频考点,把握物质的性质、发生的反应为解答本题的关键,侧重分析与应用能力的考查,注意二氧化硅与盐酸不反应,题目难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
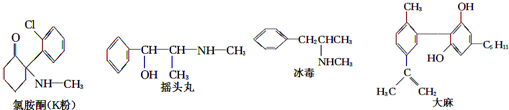
| A. | 1molK粉最多可以与3molH2发生加成反应 | |
| B. | 冰毒能与盐酸反应 | |
| C. | 适当条件下,1mol大麻最多可与2mol Br2发生反应 | |
| D. | 摇头丸具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.2 NA | |
| B. | l L 0.1mol•L-1的H2SO3溶液中含有H+的数目为0.2 NA | |
| C. | 7.8 g Na2O2中含有的阴离子数目为0.1 NA | |
| D. | 常温常压下,14 g乙烯和丙烯的混合气体中氢原子数为 2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
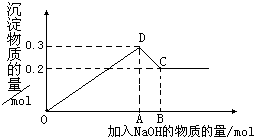 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 符合的条件 | 物质的化学式或名称 |
| (1) | 混合物 | |
| (2) | 电解质,但熔融状态下并不导电 | |
| (3) | 电解质,但难溶于水 | |
| (4) | 非电解质 | |
| (5) | 既不是电解质,也不是非电解质,但本身能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com