
某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32—、SO32—、SO42—、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下:

(1)上述离子中,溶液X中除H+外还一定含有的离子是 ,不能确定的阴离子是 ,若要用实验证明该离子存在,其化学方法是 ;
(2)写出下列反应的离子方程式:
①中生成气体A: ,
②生成沉淀I: 。
(3)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.06mol,且不能确定含有的离子只有一种。当X溶液中不能确定离子是_________,沉淀C物质的量___________。
科目:高中化学 来源:2015-2016学年安徽省高一上学期期中测试化学试卷(解析版) 题型:选择题
容量瓶上标有①压强 ②刻度线 ③浓度 ④容量 ⑤温度等项中的
A.①③⑤ B.②④⑤ C.①②③ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2016届湖南省澧县、桃源、益阳三校高三上学期联考化学试卷(解析版) 题型:选择题
1 L 0.1 mol/L AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16 g时,下列判断中正确的是
A.AgNO3溶液的浓度减小
B.阳极上产生O2
C.转移的电子数为0.02NA个
D.阴极发生了氧化反应
查看答案和解析>>
科目:高中化学 来源:2016届辽宁师范大学附属中学高三上学期期中考试化学试卷(解析版) 题型:实验题
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡, Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 。
(2)操作Ⅰ是 过滤洗涤。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两个:①调节溶液pH ② 。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g 锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0ml。锡粉中锡的纯度是 。
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第四次考试化学试卷(解析版) 题型:填空题
I.元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3 :4,且M原子的质子数是Y原子的2倍;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)写出Y、Z、N按原子个数之比1 :1:1形成的化合物的电子式_______________。
(2)写出由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子发生氧化还原反应的离子方程式:_________________。

(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________。
Ⅱ.A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3的型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
(4)D元素在元素周期表中的位置是_____。B与D所形成的化合物的化学键类型为______。
(5)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为_。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期期中考试化学试卷(解析版) 题型:填空题
有A、B、C、D、E、F六种短周期元素,其原子序数依次增大,A的单质分子内不含中子,B的某种同素异形体可以用于制作铅笔芯,C是形成氧化物种类最多的元素, D2—与E2+具有相同的电子层结构,F原子的最外层电子数与其电子层数相等。
(1)A单质的结构式 ;E2+的离子结构示意图 。
(2)C、D、E、F四种元素简单离子的离子半径由大到小的排列顺序为(用离子符号表示) 。
(3)由A和C两种元素可形成多种分子,其中有一种A、C原子个数比为3:1的分子,其电子式为 ;另一种分子中其原子个数比为2:1,已知在101kPa时,32.0g该液态化合物在氧气中燃烧,其中一种生成物为C元素形成的单质,放出热量624kJ (25℃时),写出该热化学方程式 。
(4)某抗酸药物只含A、B、D、E、F五种元素,取一定量该抗酸药进行如下实验:
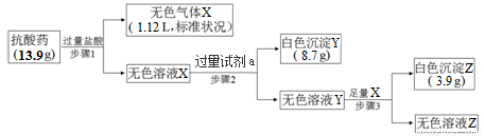
过量试剂a是 ;通过计算可知该抗酸药的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2016届江西上高第二中学高三12月月考理科综合化学试卷(解析版) 题型:选择题
现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍。下列说法正确的是
A.简单阳离子的氧化性:Y>X
B.气态氢化物的稳定性:Z>M
C.等浓度X2Z与Y2Z的溶液中,水的电离程度:X2Z>Y2Z
D.简单离子半径由大到小的顺序是:Z>M>Y
查看答案和解析>>
科目:高中化学 来源:2016届贵州遵义航天高中高三上学期第三次模拟理综化学试卷(解析版) 题型:推断题
化合物A的分子式为C9H15OCl,分子中含有一个六元环和一个甲基,环上只有一个取代基;F分子中不含甲基:A与其它物质之间的转化如下图所示:

(1) A-F的反应类型是 ;G中含氧官能团的名称是 。
(2) A-C的反应方程式是 。
(3)H的结构简式是 ,E的结构简式是 。
(4)有的同学认为B中可能没有氯原子,你的观点是 (填“同意”或“不同意”)’,你的理由 。
(5某烃的含氧衍生物X符合下列条件的同分异构体中,核磁共振氢谱显示为2组峰的是
(写结构简式);只含有两个甲基的同分异构体有 种。
①相对分子质量比C少54 ②氧原子数与C相同 ③能发生水解反应
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高一上期中考试化学试卷(解析版) 题型:选择题
在下列条件下,两种气体的分子数一定相等的是
A.同质量、不同密度的N2和C2H4
B.同温度、同体积的O2和N2
C.同体积、同密度的CO和CH4
D.同压强、同体积的N2和O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com