
| A. | 活化分子间所发生的碰撞为有效碰撞 | |
| B. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大的主要原因之一是增加了单位体积内活化分子的百分数 | |
| D. | 有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大 |
分析 A.发生有效碰撞的分子为活化分子;
B.浓度增大,活化分子数目增多;
C.升高温度,给分子提供能量,活化分子百分数增大;
D.压强增大,单位体积内活化分子的百分数增大.
解答 解:A.发生有效碰撞的分子为活化分子,活化分子有合适的取向则发生化学反应,故A错误;
B.浓度增大,活化分子数目增多,从而使反应速率增大,但单位体积内活化分子的百分数不变,故B错误;
C.升高温度,给分子提供能量,活化分子百分数增大,则反应速率加快,故C正确;
D.有气体参加的化学反应,若压强增大,相当于增大了浓度,单位体积活化分子数目增大,没有改变活化分子百分数,活化分子总数不变,故D错误;
故选C.
点评 本题考查影响化学反应速率的影响,为高频考点,把握活化分子及活化理论为解答的关键,侧重化学反应原理理解的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 |  |  |  |
| 现象 | 没有明显变化 | 有沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A. | Ⅰ中无明显变化,说明两溶液无离子反应 | |
| B. | Ⅱ中的白色沉淀为CuCl2 | |
| C. | Ⅱ中生成的BaSO4沉淀不是电解质 | |
| D. | Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
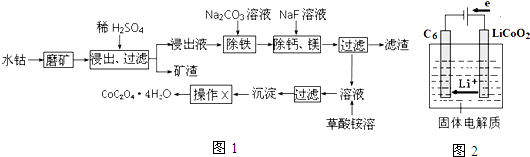
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠暗灰色固体 | |
| B. | 将金属钠在空气中加热则生成白色固体 | |
| C. | 钠投入到Fe2(SO4)3溶液中,钠先与H2O反应,钠投入到稀H2SO4中,钠也是先与H2O反应 | |
| D. | 钠钾合金在室温下呈液态,可用做原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
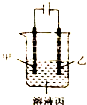
| A. | 若模拟铜的精炼原理,则乙为粗制 | |
| B. | 若模拟电镀原理,则甲为镀层金属 | |
| C. | 若模拟外加电流的阴极保护法防止金属腐蚀,则甲为被保护的金属 | |
| D. | 若甲、乙均为石墨,丙为稀硫酸,则通电一段时间后,硫酸的物质的两浓度减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com