
【题目】焦炭是重要的工业原材料。
(1)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g) 平衡常数K1;C(s)+H2O(g)
2CO(g) 平衡常数K1;C(s)+H2O(g) ![]() CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g)
CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
(2)用焦炭还原NO的反应为:2NO(g)+ C(s)![]() N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_____________ ;
②该反应的平衡常数表达式为__________________;400℃,该反应的平衡常数为_______;
③乙容器的反应温度T____400 ℃(填“>”“<”或“=”)
④丙容器达到平衡时,NO的转化率为___________;平衡时CO2的浓度为________。
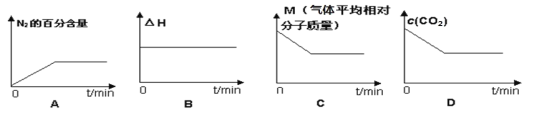
⑤在恒容密闭容器中加入焦炭并充入NO气体,下列图像正确且能说明反应达到平衡状态的是___。
【答案】K=K2/K1 0.0125molL-1min-1 c(N2)c(CO2)/c(NO)2 0.5625 > 60% 0.3mol·L-1 A
【解析】
(1)根据三个反应的平衡常数表达式可判断平衡常数之间的关系;
(2)①根据数据,计算0~40 min内用NO的浓度变化表示的平均反应速率;
②依据反应式2NO(g)+ C(s)![]() N2(g) + CO2(g),平衡常数表达式为c(N2)c(CO2)/c(NO)2;
N2(g) + CO2(g),平衡常数表达式为c(N2)c(CO2)/c(NO)2;
列出三行式,求该反应的平衡常数为;
③根据数据,在400℃时,甲丙容器,丙的充入量为甲的一半,随着反应的进行,在各个时间段内NO的浓度比甲的一半还要大,说明该反应为放热反应。再比较甲和乙,开始充入量相同,乙容器达到平衡时间短,反应快,且平衡时NO含量乙比甲多,说明温度比甲容器的高,升温平衡向逆反应方向移动,所以乙容器的反应温度T>400 ℃,
④由反应式2NO(g)+ C(s)![]() N2(g) +CO2(g)可知,
N2(g) +CO2(g)可知,
该反应为气体分子数不变的反应,改变压强不能使平衡发生移动,甲丙两容器建立等温等容条件下的等效平衡,NO的转化率和甲容器平衡时转化率相同;平衡时CO2的浓度为甲容器的一半。
⑤可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的物理量不变,以此分析。
(1)反应C(s)+CO2(g) ![]() 2CO(g)中K1=
2CO(g)中K1=![]() ,
,
反应C(s)+H2O(g) ![]() CO(g)+H2(g)中K2=
CO(g)+H2(g)中K2=![]() ,
,
反应CO(g)+H2O(g)![]() H2(g)+CO2(g)中K=
H2(g)+CO2(g)中K=![]() ,所以K= K=K2/K1,
,所以K= K=K2/K1,
故答案为:K=K2/K1;
(2)①根据数据,甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=![]() =0.0125molL-1min-1;
=0.0125molL-1min-1;
故答案为:0.0125molL-1min-1。
②依据反应式2NO(g)+ C(s)![]() N2(g) + CO2(g),平衡常数表达式为c(N2)c(CO2)/c(NO)2;400℃,甲容器120min时达到平衡,
N2(g) + CO2(g),平衡常数表达式为c(N2)c(CO2)/c(NO)2;400℃,甲容器120min时达到平衡,
2NO(g)+ C(s)![]() N2(g) + CO2(g)
N2(g) + CO2(g)
起始量(mol) 2.00 0 0
转化量(mol) 1.20 0.60 0.60
平衡量(mol) 0.80 0.60 0.60
则该反应的平衡常数为![]() =0.5625;
=0.5625;
故答案为:0.5625。
③根据数据,在400℃时,甲丙容器,丙的充入量为甲的一半,随着反应的进行,在各个时间段内NO的浓度比甲的一半还要大,说明该反应为放热反应。再比较甲和乙,开始充入量相同,乙容器达到平衡时间短,反应快,且平衡时NO含量乙比甲多,说明温度比甲容器的高,升温平衡向逆反应方向移动,所以乙容器的反应温度T>400 ℃,
故答案为:>。
④由反应式2NO(g)+ C(s)![]() N2(g) +CO2(g)可知,
N2(g) +CO2(g)可知,
该反应为气体分子数不变的反应,改变压强不能使平衡发生移动,甲丙两容器建立等温等容条件下的等效平衡,NO的转化率和甲容器平衡时转化率相同,为![]() 100%=60%;平衡时CO2的浓度为甲容器的一半,为
100%=60%;平衡时CO2的浓度为甲容器的一半,为![]() =0.3mol/L。
=0.3mol/L。
故答案为:60% ;0.3mol·L-1。
⑤可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的物理量不变,
A.N2的百分含量不变,说明达到平衡状态,故A选;
B.焓变对于确定的反应是恒定量,不能作为达到平衡的标志,故B不选;
C. 根据反应式2NO(g)+ C(s)![]() N2(g) + CO2(g),平均摩尔质量M=
N2(g) + CO2(g),平均摩尔质量M=![]() ,气体总物质的量不变,气体质量增加,所以气体平均摩尔质量应增大。故C不选;
,气体总物质的量不变,气体质量增加,所以气体平均摩尔质量应增大。故C不选;
D.CO2的浓度开始应为0,后来增加,故图像不正确,故D不选。
故答案为:A。


科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数(NA)的说法错误的是( )
A. 32gO2所含的原子数目为NA
B. 0.5molH2O含有的原子数目为1.5NA
C. 1molH2O含有的H2O分子数目为NA
D. 0.5NA个CO2的物质的量是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯的叙述不正确的是( )
A. 乙烯分子中6个原子处于同一平面
B. 乙烯易溶于水,也易溶于有机溶剂
C. 乙烯分子中所含共价键的类型不止一种
D. 乙烯的产量是衡量一个国家石油化工发展水平的标志
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下反应条件的控制中,不恰当的是( )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO3的分解速率而加入MnO2
D.降温加快H2O2的分解速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:①有氧气生成;②____________。Na2O2跟水反应的化学方程式是____________。
(2)某研究性学习小组拟用如图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验方法是_________;用以验证第二条结论的实验方法是________。

(3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为____。
(4)将Cl2制成漂白粉的主要目的是________(填字母)。
A.增强漂白能力和消毒作用
B.使它转化为较稳定物质,便于保存和运输
C.使它转化为较易溶于水的物质
D.提高氯的质量分数,有利于漂白、消毒
(5)将漂白粉溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的化学方程式为_________。
(6)瓶装漂白粉久置空气中会呈稀粥状而失去漂白作用。试用化学方程式表示漂白粉在空气中易失效的原因是①_____________;②__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.用水鉴别乙醇、苯和溴苯
B.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
C.橡胶、蛋白质、尼龙、纤维素都是天然高分子化合物
D.通常所说的三大合成材料是指塑料、合成纤维和合成橡胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.02mol/L的NaOH溶液,分别滴定浓度为0.0lmol/L的三种稀酸溶液,滴定的曲线如右图所示,下列判断正确的是

A. 三种酸均为弱酸,且同浓度的稀酸中导电性:HA<HB<HD
B. 滴定至P点时,溶液中:c(HB)>c(B-)
C. 溶液呈中性时,三种溶液中:c(A-)>c(B-)>c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下下列各组离子在指定溶液中能大量共存的是 ( )
A. c(H+)/c(OH-)=1×1012的溶液中:NH、Cl-、NO、Al3+
B. 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO、K+
C. pH=1的溶液中:Fe2+、NO、SO![]() 、Na+
、Na+
D. c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO![]() 、SCN-
、SCN-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com