
| 2.0×10-10 |
| 1×10-5 |
| 2.0×10-12 |
| (2×10-5)2 |
| 58.5g×cV×10-3mol |
| 1mol |
| 5.85cV×10-3×10 |
| m |
| 5.85cV×10-3×10 |
| m |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| 实验 混合溶液 | A | B | C | D | E | F |
| 等浓度的稀草酸溶液/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Cl2光照 |
| ① |
| NaOH溶液 |
| ② |
| Cu、O2、加热 |
| ③ |
| 银氨溶液加热、酸化 |
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
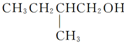 在Ag存在和加热条件下与O2反应的化学方程式:
在Ag存在和加热条件下与O2反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
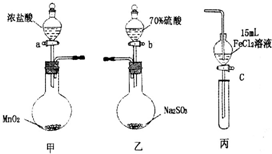 为验证氧化性C12>Fe3+>SO2某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).
为验证氧化性C12>Fe3+>SO2某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).| 步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |||
| Ⅰ | 既有Fe3+又有Fe2+ | 有SO
| ||
| Ⅱ | 有Fe3+无Fe2+ | 有SO
| ||
| Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
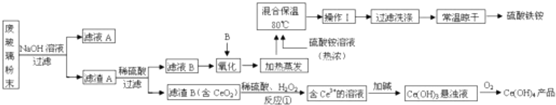
查看答案和解析>>
科目:高中化学 来源: 题型:
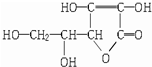
| A、维生素C难溶于水 |
| B、维生素C可作食品添加剂 |
| C、维生素C不可能发生水解反应 |
| D、维生素C能发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com