
【题目】下列叙述中,正确的是
A. 自然界中存在大量单质硅
B. 石英、水晶、硅石的主要成分都是二氧化硅
C. 常温下硅性质活泼,能与氯气、强酸反应
D. 自然界中的硅都是以二氧化硅的形式存在
 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】某烷烃相对分子质量为86,跟Cl2反应生成一氯取代物只有两种,它的结构简式、名称全正确的是( )
A. CH3(CH2)4CH3 己烷 B. (CH3)2CHCH(CH3)22,3-二甲基丁烷
C. (C2H5)2CHCH32-乙基丁烷 D. C2H5C(CH3)32,2-二甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向BaSO4饱和溶液中加入少量的氯化钡溶液产生沉淀,若以Ksp表示BaSO4的溶度积常数,则反应后的悬浊液中
A. c(Ba2+)=c(SO42-) B. c(Ba2+)·c(SO42-)=Ksp
C. c(Ba2+)·c(SO42-)>Ksp D. c(Ba2+)·c(SO42-)<Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:PCl5(g) ![]() PCl3(g)+Cl2(g)① 2HI(g)
PCl3(g)+Cl2(g)① 2HI(g) ![]() H2(g)+I2(g)② 2NO2(g)
H2(g)+I2(g)② 2NO2(g) ![]() N2O4(g)③在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则反应物的转化率( )
N2O4(g)③在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则反应物的转化率( )
A. 均不变 B. 均增大
C. ①增大,②不变,③减小 D. ①减小,②不变,③增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)![]() CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A. 0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
B. 1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
C. 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D. 0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) ![]() N2O4(g) ΔH<0,反应相同时间后,分别测定五个容器中NO2的百分含量(NO2%),并作出NO2%与对应不同温度的五个容器的关系图。下列示意图中,可能与实验结果相符的是( )
N2O4(g) ΔH<0,反应相同时间后,分别测定五个容器中NO2的百分含量(NO2%),并作出NO2%与对应不同温度的五个容器的关系图。下列示意图中,可能与实验结果相符的是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
强电解质 | 弱电解质 | 非电解质 | |
A | 硫酸 | 醋酸 | 氯气 |
B | 盐酸 | 碘化氢 | 乙醇 |
C | 醋酸铵 | NH3·H2O | 三氧化硫 |
D | 硫酸钡 | 碳酸氢钠 | 氨气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中某区域的一些元素通常用来制造农药,这些元素是( )
A. 左下方区域的金属元素
B. 金属元素和非金属元素分界线附近的元素
C. 右上方区域的非金属元素
D. 稀有气体元素
查看答案和解析>>
科目:高中化学 来源: 题型:
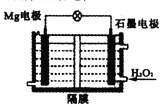
【题目】金属Mg及其化合物有重要的用途,请回答下列问题
(1)MgO的重要用途有_______。(写出一种)
(2)井水中含有较多的Ca2+、Mg2+、HCO3-等离子,可以通过煮沸的方式将Mg2+转化为Mg(OH)2,发生的离子方程式是:__________________。
(3)金属Mg可以用来冶炼Ti:2Mg+TiCl4![]() Ti+2MgCl2。可以用作该反应保护气的是_______。
Ti+2MgCl2。可以用作该反应保护气的是_______。
A. He B. C02 C.N2 D.HCl
(4)在蒸发皿中放人研细的碘和镁粉,无现象,滴入几滴水后立即产生大量的紫烟,紫烟的成分是_________(填分子式);对于实验中水的作用,甲同学认为是水溶解了I2,增大了I2与Mg的接触面积,导致了反应加快,乙同学认为是I2与H2O反应生成了酸,是酸与Mg反应放出热量,加快了I2与Mg的反应,请利用供选试剂:0.01mol/L I2的CCl4溶液、0.01 mol/L I2水、I2粉、Mg粉、蒸馏水,设计实验证明哪位同学的说法合理:____________。(包括实验过程、现象和结论)
(5)一种新型的Mg-H2O2酸性介质电池工作原理如图,正极发生的电极方程式为:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com