
下表是元素周期表的一部分。
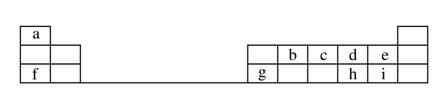
回答下列问题:
(1)元素b在元素周期表中的位置是________。
(2)元素a与c形成的4核10电子分子的化学式为________,其水溶液呈________性。
(3)元素e的负一价离子的结构示意图为________,元素g的简单离子的结构示意图为________,二者的离子半径大小顺序为________。
(4)元素i的气态氢化物比元素e的气态氢化物________(填“稳定”或“不稳定”)。
(5)元素i的单质溶于元素f的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的电子式为______________,该化合物中所含的化学键类型为________________。
(6)元素d与h形成的化合物的化学式为____________________。
答案 (1)第二周期第ⅣA族 (2)NH3 碱
(3)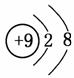
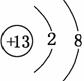 F->Al3+ (4)不稳定
F->Al3+ (4)不稳定
(5)Na+- 离子键和共价键
(6)SO2、SO3
解析 根据元素周期表的结构知,a为H,b为C,c为N,d为O,e为F,f为Na,g为Al,h为S,i为Cl。(1)C(碳)位于元素周期表中第二周期第ⅣA族。(2)H与N形成的4核10电子分子为NH3,其水溶液呈碱性。
(3)F-的结构示意图为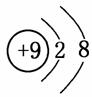 ,Al3+的结构示意图为
,Al3+的结构示意图为 ,根据“序小径大”的原则可知,离子半径:F->Al3+。(4)F、Cl为同主族元素,F的非金属性比Cl的强,故HF比HCl稳定。(5)Cl2与NaOH溶液反应生成NaClO和NaCl两种盐,其中NaClO具有漂白性,其电子式为Na+-,该化合物中含有离子键和共价键。(6)O与S可形成SO2、SO3。
,根据“序小径大”的原则可知,离子半径:F->Al3+。(4)F、Cl为同主族元素,F的非金属性比Cl的强,故HF比HCl稳定。(5)Cl2与NaOH溶液反应生成NaClO和NaCl两种盐,其中NaClO具有漂白性,其电子式为Na+-,该化合物中含有离子键和共价键。(6)O与S可形成SO2、SO3。


科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.标准状况下, 22.4L水含有NA个H2O分子
B.lmol Fe与足量氯气反应时失去的电子数为2NA
C.常温常压下,22. 4LCl2含有2NA个Cl原子
D.32g由氧气和臭氧组成的混合物中含有氧原子的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同。下列判断不正确的是( )
A.乙元素的族序数比甲元素的族序数大
B.甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙
C.原子半径的大小:甲>乙
D.含乙元素的化合物数目比含甲或丙元素的化合物数目多
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.46 g乙醇中含有的化学键数为7NA
B.1 mol氯气和足量NaOH溶液反应转移电子数为2NA
C.1 mol OH-和1 mol —OH(羟基)中含有的质子数均为9NA
D.10 L 0.1 mol·L-1的Na2CO3溶液中,Na+、CO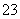 总数为3NA
总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)2 mol O3和3 mol O2的质量之比________,分子数之比________,含氧原子数之比________,同温同压下的密度之比________,体积之比______________。
(2)O3和Cl2具有相似的性质,均可用于自来水消毒。已知二者在消毒时均被还原为最低价态,则相同状况下10 L O3与________L Cl2的消毒能力相当。
(3)气体化合物A的分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的分子式为________,推断依据为_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应的自发性叙述中正确的是
A.焓变小于0而熵变大于0的反应肯定是自发的
B.焓变和熵变都小于0的反应肯定是自发的
C.焓变和熵变都大于0的反应肯定是自发的
D.熵变小于0而焓变大于0的反应肯定是自发的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com