
分析 (1)①A.用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,说明碳酸铅的溶解度小于硫酸铅;
B.浓度不变不一定相等;
C.反应的平衡常数K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$,其分子和分母同乘以铅离子的浓度结合Ksp分析;
②碳酸根离子浓度越大硫酸铅的转化率越高,而碳酸钠直接电离产生碳酸根离子,而碳酸氢钠是多元弱酸的酸式盐,盐电离产生的酸根离子碳酸氢根离子微弱的电离产生碳酸根离子;
(2)溶液中得到溶质晶体的方法为蒸发浓缩、冷却结晶、过滤洗涤、干燥等操作;该晶体的阴离子为硫酸根离子,根据检验硫酸根离子的方法解答;
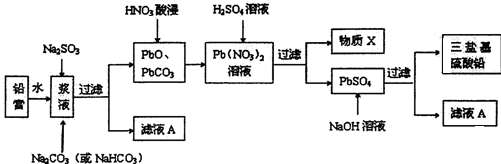
(3)根据制取流程可知,利用废旧铅蓄电池阴、阳极填充物(铅膏)制备塑料加工热稳定剂三盐基硫酸铅实验流程.向铅膏浆液中加入Na2SO3溶液的目的是将PbO2还原PbO,Na2SO3+PbO2=PbO+Na2SO4,加Na2CO3溶液是将PbSO4转化成PbCO3,所以滤液Ⅰ主要是Na2SO4溶液.PbO和PbCO3在硝酸的作用下转化成Pb(NO3)•Pb(NO3)中加稀H2SO4转化成PbSO4和硝酸,因此X为HNO3;
若母液中残留的SO42-过多,浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率;
(4)根据流程可知,PbSO4与氢氧根离子反应生成三盐基硫酸铅,据此写出反应的离子方程式;
(5)根据电子守恒可得关系式Na2SO3~2e-~PbO2,则n(Na2SO3)=n( PbO2),再根据V=$\frac{n}{c}$计算出需要0.5mol/L Na2SO3溶液的体积.
解答 解:(1)①A.用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,说明碳酸铅的溶解度小于硫酸铅,所以PbSO4的Ksp比PbCO3的Ksp大,故正确;
B.浓度不变不一定相等,故错误;
C.根据反应的平衡常数的表达式书写,K=$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$的分子和分母同乘以铅离子的浓度,即K=$\frac{{K}_{SP}(PbS{O}_{4})}{{K}_{SP}(PbC{O}_{3})}$,故正确;
故选:B;
②碳酸根离子浓度越大硫酸铅的转化率越高,而碳酸钠直接电离产生碳酸根离子,而碳酸氢钠是多元弱酸的酸式盐,盐电离产生的酸根离子碳酸氢根离子微弱的电离产生碳酸根离子,所以同浓度的两种盐,碳酸钠溶液中的碳酸根离子浓度大于碳酸氢钠溶液中碳酸根离子的浓度,
故答案为:Na2CO3;相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32-)较大;
(2)回收Na2SO4•10H2O,温度不宜过高,否则容易失去结晶水,所以溶液中得到溶质晶体的方法为:蒸发浓缩,冷却结晶,过滤洗涤,干燥等;Na2SO4•10H2O中阴离子为SO42-,检验硫酸根离子的方法为:取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42-,
故答案为:蒸发浓缩;冷却结晶;取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42-;
(3)由流程可知,PbO和PbCO3在硝酸的作用下转化成Pb(NO3)2 ,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,因此X为HNO3,HNO3在反应流程中可循环利用;
若母液中残留的SO42-过多,浸出时部分铅离子会与SO42-反应生成PbSO4随浸出渣排出,降低了PbSO4的产率,
故答案为:HNO3 ;浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率;
(4)硫酸铅在碱溶液中与氢氧根离子反应生成三盐基硫酸铅,反应的离子方程式为:4PbSO4+6OH-=3PbO•PbSO4•H2O+3SO42-+2H2O,
故答案为:4PbSO4+6OH-=3PbO•PbSO4•H2O+3SO42-+2H2O;
(5)向铅膏浆液中加入Na2SO3溶液的目的是将PbO2还原为PbO,若实验中所取铅膏浆液质量为47.8g,其中PbO2的质量分数为15.0%,要将PbO2还原,加入的亚硫酸钠依据化学方程式定量关系和电子守恒计算得到:Na2SO3~2e-~PbO2,
则:n(Na2SO3)=n( PbO2)=$\frac{47.8g×15%}{239g/mol}$=0.03mol,
所以需要亚硫酸钠溶液的体积为:$\frac{0.03mol}{0.5mol/L}$=0.06L=60mL,
故答案为:60.
点评 本题通过三盐基硫酸铅的制备流程,考查了物质制备方案的设计方法,题目难度中等,注意掌握物质制备方案的设计原则,正确分析制备流程得出物质的制备原理为解答此类题的关键,试题有利于提高学生的分析、理解能力及化学实验能力,试题的综合性较强,是一道质量较好的题目.


科目:高中化学 来源: 题型:解答题
 的系统名称是3,4-二甲基-3-乙基己烷
的系统名称是3,4-二甲基-3-乙基己烷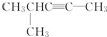 系统命名为4-甲基-2-戊炔
系统命名为4-甲基-2-戊炔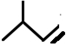
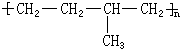 所示,形成该高聚物的单体的结构简式分别
所示,形成该高聚物的单体的结构简式分别查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
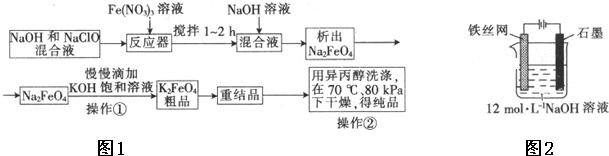
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
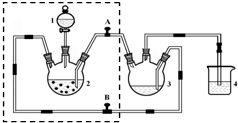 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

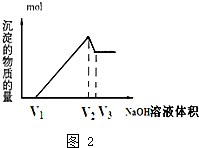
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
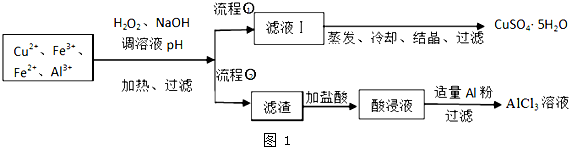
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成份 | 浓度/(mol•L-1) | 质量分数 |
| HCl FeCl2 FeCl3 | -- 1.920 0.071 | 5.00% 8.94% 0.33% |
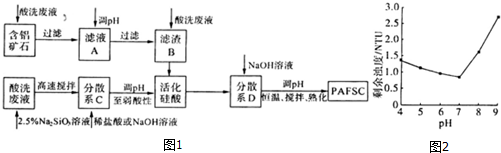
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com