
����Ŀ��ʮ�Ŵ����Ҫ�Ի����������ȫ�桢ϵͳ�Ŀɳ�����������ɫ��Դ��ʵʩ�ɳ�����չ����Ҫ;�������������Ҵ�����ȡ��ɫ��Դ�����IJ��ַ�Ӧ��������ͼ��ʾ��
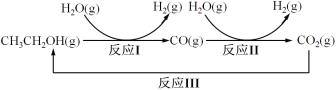
��1����֪��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H1= - 41 kJ/mol
CO2(g)+H2(g) ��H1= - 41 kJ/mol
CH3CH2OH(g)+3H2O(g)![]() 2CO2(g)+6H2(g) ��H2=+174.1 kJ/mol
2CO2(g)+6H2(g) ��H2=+174.1 kJ/mol
��д����ӦI���Ȼ�ѧ����ʽ_____________________________��
��2����ӦII���ڽ�����[n(CO) : n(H2O)]��ͬʱ�������Ӧ��COƽ��ת���ʼ���ͼ
�������Ӧ�ķ�Ӧ�¶ȿ�����ͬ��Ҳ���ܲ�ͬ�������Ӧ��������Ӧ��������ͬ����

�� ��������A��E��G�����Ӧ�ķ�Ӧ�¶���ͬ����ԭ����KA=KE=KG=________������ֵ�����ڸ��¶��£�Ҫ���COƽ��ת���ʣ����˸ı������֮�⣬���ɲ�ȡ�Ĵ�ʩ��________��
�� �Աȷ���B��E��F���㣬�ɵó���Ӧ�Ľ����Ⱥͷ�Ӧ�¶ȵı仯����֮��Ĺ�ϵ��_____________________________________________________________��
�� �Ƚ�A��B�����Ӧ�ķ�Ӧ���ʴ�С��VA______VB������� ��=������������Ӧ����v=v����v��=![]() ��
��![]() ��k����k���ֱ�Ϊ��������Ӧ���ʳ�����xΪ���ʵ��������������ڴﵽƽ��״̬ΪD��ķ�Ӧ�����У���COת���ʸպôﵽ20%ʱ
��k����k���ֱ�Ϊ��������Ӧ���ʳ�����xΪ���ʵ��������������ڴﵽƽ��״̬ΪD��ķ�Ӧ�����У���COת���ʸպôﵽ20%ʱ![]() =__________ ������������1λС������
=__________ ������������1λС������
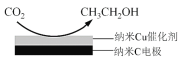
��3����ӦIII������̼�����Һ����CO2�õ����͵�KHCO3���Һ�������CO2���Ʊ��Ҵ���
����֪̼��ĵ��볣��Ka1=10-a��Ka2=10-b����������CO2���ñ���KHCO3��Һ��pH=c�������Һ��lg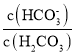 =____________________________________���г�����ʽ����
=____________________________________���г�����ʽ����
���ڱ���KHCO3���Һ�е��CO2���Ʊ��Ҵ���ԭ����ͼ��ʾ���������ĵ缫��Ӧʽ��_____________________________________________________________________��
���𰸡�CH3CH2OH(g)+H2O(g)��4H2(g)+2CO(g) ��H=+256.1kJ/mol 1 ��ʱ��ȥ���� ������Խ��Ӧ�¶�Խ��(�������ԽС����Ӧ�¶�Խ��) �� 36.0 c-a 14CO2+12e-+9H2O��CH3CH2OH+12HCO3-
��������
(1)��ӦI��ѧ����ʽΪCH3CH2OH(g)+H2O(g)��4H2(g)+2CO(g)����Ϊ��CO(g)+H2O(g)CO2(g)+H2(g)��H1=-41kJ/mol����CH3CH2OH(g)+3H2O(g)2CO2(g)+6H2(g)��H2=+174.1kJ/mol�����ݸ�˹���ɣ�����-�١�2�ã�CH3CH2OH(g)+H2O(g)��4H2(g)+2CO(g) ��H=+174.1kJ/mol��(-41kJ/mol)��2=+256.1kJ/mol�����Ȼ�ѧ����ʽΪCH3CH2OH(g)+H2O(g)��4H2(g)+2CO(g) ��H=+256.1kJ/mol���ʴ�Ϊ��CH3CH2OH(g)+H2O(g)��4H2(g)+2CO(g) ��H=+256.1kJ/mol��
(2)�ٷ�ӦIIΪCO(g)+H2O(g)CO2(g)+H2(g)������A��E��G�����Ӧ�ķ�Ӧ�¶���ͬ����ƽ�ⳣ��KA=KE=KG������E����ֵ���м��㣺ͼ��E����ֵΪ(1��0.5)����Ӧ������ʽΪ��

ƽ�ⳣ��K=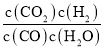 =
=![]() =1��CO(g)+H2O(g)CO2(g)+H2(g)��H=-41kJmol-1��������Ϊ�����������ķ��ȷ�Ӧ�����Ժ��������£�����H2O(g)��Ũ�Ȼ�ʱ�����CO2�Ȳ���������CO��ƽ��ת���ʣ��ʴ�Ϊ��1����ʱ��ȥ���
=1��CO(g)+H2O(g)CO2(g)+H2(g)��H=-41kJmol-1��������Ϊ�����������ķ��ȷ�Ӧ�����Ժ��������£�����H2O(g)��Ũ�Ȼ�ʱ�����CO2�Ȳ���������CO��ƽ��ת���ʣ��ʴ�Ϊ��1����ʱ��ȥ���
����ͼ��֪����CO��ת������ͬʱ���¶��ɵ͵��ߣ���Ӧ�Ľ�����Ϊ0.5��1��1.5���������Խ�ߴﵽ��ͬת����������¶�Խ�ͣ���������Խ��Ӧ�¶�Խ�ͻ������ԽС����Ӧ�¶�Խ�ߣ��ʴ�Ϊ��������Խ��Ӧ�¶�Խ��(�������ԽС����Ӧ�¶�Խ��)��
��CO(g)+H2O(g)CO2(g)+H2(g)��H1=-41kJ/mol����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������У�COת���ʼ�С����B���¶ȸߣ���Ӧ���ʿ죬��VA��VB��D����ֵΪ(1��0.6)����Ӧ����ʽΪ��

D ���¶��µ�ƽ�ⳣ��K=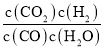 =
=![]() =2.25����Ӧ�ﵽƽ��ʱv��=v������k��xCO��xH2O=k��xCO2��xH2������
=2.25����Ӧ�ﵽƽ��ʱv��=v������k��xCO��xH2O=k��xCO2��xH2������![]() =
=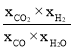 =
=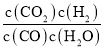 =K=2.25���ڴﵽƽ��״̬ΪD��ķ�Ӧ�����У���COת���ʸպôﵽ20%ʱ������ʽ��
=K=2.25���ڴﵽƽ��״̬ΪD��ķ�Ӧ�����У���COת���ʸպôﵽ20%ʱ������ʽ��

xCO=xH2O=![]() =0.4��xCO2=xH2=0.1��������
=0.4��xCO2=xH2=0.1��������![]() =
=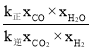 =K��
=K��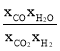 =2.25��
=2.25��![]() =36.0���ʴ�Ϊ������36.0��
=36.0���ʴ�Ϊ������36.0��
(3)��pH=cʱc(H+)=10-cmol/L��KHCO3��ˮ��Ϊ����HCO3-+H2OH2CO3+OH-��ƽ�ⳣ��K=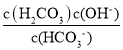 =
=![]() ����
����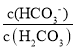 =
=![]() ��c(OH-)=
��c(OH-)=![]() =
=![]() =10c-a������lg
=10c-a������lg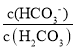 =lg10c-a=c-a���ʴ�Ϊ��c-a��
=lg10c-a=c-a���ʴ�Ϊ��c-a��
������ʧȥ���ӷ���������Ӧ���ʵ缫��Ӧ����ʽ14CO2+12e-+9H2O��CH3CH2OH+12HCO3-���ʴ�Ϊ��14CO2+12e-+9H2O��CH3CH2OH+12HCO3-��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ԷϾ�п�̵���еĺ��̷ۣ�MnO2��MnO(OH)��NH4Cl������ZnCl2��̿�ڡ��������ȣ�Ϊԭ���Ʊ�MnCl2��ʵ���̵������á��乤���������£�

��1�����̢��ڿ����м��Ⱥ��̷۵�Ŀ���dz�̿������MnO(OH)�ȡ�O2����MnO(OH)�Ļ�ѧ����ʽ��_______��
��2����Һa����Ҫ�ɷ�ΪNH4Cl�������������ZnCl2�ȡ�

�� ��Һa�����ԣ�ԭ����______��
�� ������ͼ��ʾ���ܽ�����ߣ�����Һa______������������ɵ�NH4Cl��Ʒ��
�� �ᴿNH4Cl��Ʒ���й������������£�
������ | ZnCl2 | NH4Cl |
�۵� | 365�� | 337.8��ֽ� |
�е� | 732�� | ------------- |
�����ϱ�����Ʒ����ᴿNH4Cl��________��
��3������MnSO4��Һ���Ƿ���Fe3+��ȡ������Һ������_______�����Լ�������֤����Һ��Fe3+������ȫ��
��4��̽�����̢���MnO2�ܽ������������
������MnO2�м���H2O2��Һ�������������ݣ��ټ���ϡH2SO4������δ�����ܽ⡣
������MnO2�м���ϡH2SO4������δ�ܽ⣻�ټ���H2O2��Һ�������������ݣ�������ȫ�ܽ⡣
�� �û�ѧ����ʽ��ʾ����MnO2�ܽ��ԭ��________��
�� �����Լ�����˳��ͬ��MnO2���ò�ͬ��ԭ��________��
����ʵ��˵�����Լ�����˳��ͬ���������ֵ����ʿ��ܲ�ͬ������Ҳ���ܲ�ͬ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾʵ��װ�ý����������ʵ�̽��ʵ�顣����˵������������( )
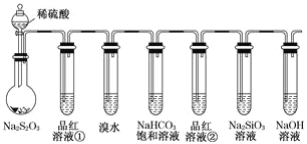
A.��Ʒ����Һ����ɫ����˵�������к���SO2
B.����ˮ��ɫ����˵��SO2���л�ԭ��
C.����ƿ�в�����ɫ���Ǻ���ɫ���ݣ���˵��Na2S2O3ֻ��������
D.��Ʒ����Һ�ڲ���ɫ��Na2SiO3��Һ�г��ְ�ɫ���ǣ���˵�������̼���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС�����������ʵ��ⶨ�����е�Ԫ�صĺ��������ξ��������ĸ����裬����ͼʾװ�ú�ԭ���ܴﵽʵ��Ŀ�ĵ���
A.���պ���
B.���������ܽ����������������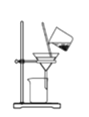
C.�Ʊ�Cl2������I-����ΪI2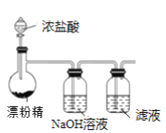
D.�Ե���Ϊָʾ������Na2SO3����Һ�ζ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��A��B��C��D��ͬ���ڻ�ͬ���������Ԫ�أ�
D | ||
A | B | C |
(1)��֪��AԪ�ص���ͼ�Ϊ-3�ۣ�������������ﺬ��56.34%��ԭ�Ӻ�������������������1������AԪ��ԭ�ӵ�������Ϊ_____��
(2)д��Ԫ�ط��ţ�A_____��C_____��D____��
(3)A��B��C����Ԫ������������ˮ������������ǿ����____(�ѧʽ)��
(4)B��D����Ԫ�غ�����ɵ���̬�⻯�����ȶ�����ǿ����___����ԭ����ǿ��____(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.CH3Cl(g)+Cl2(g)![]() CH2Cl2(l)+HCl(g)���Է����У���÷�Ӧ����H>0
CH2Cl2(l)+HCl(g)���Է����У���÷�Ӧ����H>0
B.�����£�ϡ��0.1 mol��L1 NH4Cl��Һ����Һ��![]() ����
����
C.��ӦN2(g)+3H2(g)![]() 2NH3(g) ��H<0��ƽ������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С��ƽ��������Ӧ�����ƶ�
2NH3(g) ��H<0��ƽ������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С��ƽ��������Ӧ�����ƶ�
D.�����ᱵ����Һ�м�����������Na2CO3��Һ�������ˡ�ϴ�ӣ�������м������������������˵��Ksp(BaSO4)��Ksp(BaCO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ʵ��������������ó��Ľ�����ȷ����
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ��SO2����ͨ������KMnO4��Һ | ��Һ��ɫ | SO2����Ư���� |
B | ��CuSO4��Һ�м���KI��Һ���ټ��뱽���� | �а�ɫ����������������Ϻ�ɫ | Cu2+�������ԣ���ɫ��������ΪCuI |
C | ������Һ�зֱ�����ȩ��(NH4)2SO4������Һ | ���а�ɫ�������� | �����ʾ������˱��� |
D | ��5 mL 0.1 mol��L1 KI��Һ�м���1 mL 0.1 mol��L1 FeCl3��Һ�����ñ���ȡ2��3�κ�ȡ�²���Һ�μ�5��KSCN��Һ | ����Ѫ��ɫ | ��Ӧ2Fe3++2I |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ɫ����ˮ����ζ��Һ�壬�е�Ϊ77.2�棬ʵ����ij����ȡ���ñ�����14.3mL��95%�Ҵ�23mL�����õ�Ũ���ᡢ����̼�����Լ��������Ҵ���ϳ���ˮ������Ȼ�����Һ����Ҫװ����ͼ��ʾ��

ʵ�鲽�裺
������A�е�������ƿ��ע�������Ҵ���Ũ�����ҡ�ȣ��ٽ�ʣ�µ������Ҵ��ͱ�����ע���Һ©������á���ʱ��Һ©�����������Ҵ������ʵ���֮��ԼΪ5��7��
�ڼ�����ԡ����Լ135 �桫145��
�۽���Һ©���е�Һ�建������������ƿ����ڼ�������ʹ��������������������ʴ�����ȣ�ֱ��������ɡ�
�ܱ�����ԡ�¶�һ��ʱ�䣬��������Һ�������ֹͣ���ȡ�
��ȡ��B�е���ƿ����һ��������Na2CO3��Һ����������εؼӵ����Һ��ӱ����������ݲ���Ϊֹ��
���ݵ�Һ�������Һ����ȥˮ�㡣
�߽�����CaCl2��Һ�����������뵽��Һ©���У���һ��ʱ����ã��ų�ˮ�㣨��Һ����
���Һ©����õ����dz����ᴿ������������Ʒ��
�Իش�
(1)ʵ����Ũ�������Ҫ������_________________________��
(2)�ù����Ҵ�����ҪĿ����____________________________��
(3)�ñ���Na2CO3��Һϴ�Ӵ�����Ŀ����_______________________��
(4)�ñ���CaCl2��Һϴ�Ӵ�����Ŀ����_______________________��
(5)�ڲ�������õĴ����ﻹ���е�������_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������4NH3(g)+3O2(g)=2N2(g)+6H2O(g)�ķ�Ӧ��˵,���»�ѧ��Ӧ���ʵı�ʾ�з�Ӧ���������ǣ� ��
A.v(NH3)=0.6mol��L-1��s-1B.v(O2)=0.4mol��L-1��s-1
C.v(N2)=0.2mol��L-1��s-1D.v(H2O)=1.2mol��L-1��min-1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com