
【题目】如图所示,a、b为等质量的电极,电解槽中盛有1 L 1.0 mol·L-1CuSO4溶液,电解前后溶液体积变化忽略不计,下列有关叙述正确的是
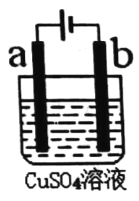
A.电子的流向:负极→b→a→正极
B.若为电解精炼铜装置,则a为粗铜;若为电镀铜装置,则b为纯铜
C.电镀铜或电解精炼铜,溶液中Cu2+浓度均不变
D.若为电镀铜,当电路中通过的电子为0.2mol时,两极的质量相差12.8g
【答案】D
【解析】
A.该装置为电解池,a极连接外加电源正极,b极连接外加电源负极,电子移动方向为负极→b,a→正极,电子不能通过电解质溶液,故A错误;
B.若为电解精炼铜的装置,粗铜作阳极,则a极为粗铜,若为电镀铜的装置,纯铜作阳极,则a极为纯铜,故B错误;
C.电镀铜时,溶液中铜离子浓度不变,电解精炼铜时,由于粗铜中含有Zn、Fe、Ag等杂质,锌、铁等失电子时,铜离子在阴极析出,因此溶液中铜离子浓度减小,故C错误;
D.若为电镀铜,a极的电极反应为Cu -2e-=Cu2+,b极的电极反应为Cu2++2e-=Cu,当电路中通过的电子为0.2mol时,a极消耗0.1mol铜,b极生成0.1mol铜,两个电极质量的差值为(0.1+0.1)mol×64g/mol=12.8g,故D正确;
答案选D。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
【题目】![]() 在药物和染料的制取中有重要作用,沸点69℃,100℃以上分解生成两种常见气体。实验室对其稳定性和分解产物的部分性质分别进行了如下探究。已知:反应开始后,乙瓶中始终无色,戊瓶中有黄绿色气体。
在药物和染料的制取中有重要作用,沸点69℃,100℃以上分解生成两种常见气体。实验室对其稳定性和分解产物的部分性质分别进行了如下探究。已知:反应开始后,乙瓶中始终无色,戊瓶中有黄绿色气体。
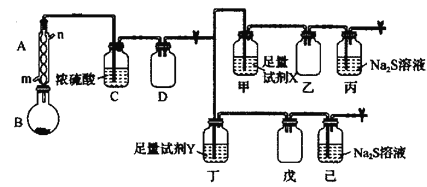
回答下列问题:
(1)装置A中的进水口为______,仪器B的名称为______,加热B的方式最好选用______(填“水浴加热”或“油浴加热”)。
(2)装置C的作用为____________,装置D的作用为____________。
(3)试剂X、Y分别为下列试剂中的______、______(填标号)。
a.品红溶液 b.氢氧化钠溶液 c.高锰酸钾溶液 d.四氯化碳
(4)若进入丙中的气体过量,则丙中的现象为____________,发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能发生并用于化工生产的是()
A.制盐酸:Cl2+H2![]() 2HCl
2HCl
B.制取镁:MgCl2(溶液)![]() Mg+Cl2
Mg+Cl2
C.制乙烯:C2H5OH![]() CH2=CH2+H2O
CH2=CH2+H2O
D.制乙醇:CH2=CH2+H2O![]() C2H5OH
C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1 molH—H键吸收436 kJ能量,断裂1mol Cl—Cl键吸收243kJ能量,形成1 molH—Cl键放出431 kJ能量。
H2+Cl2===2HCl的化学反应可用如图表示:
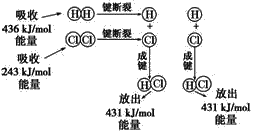
请回答下列有关问题:
(1)反应物断键吸收的总能量为____。
(2)生成物成键放出的总能量为____。
(3)1molH2和1molCl2反应生成2molHCl是_____(填“吸收”或“放出”)能量的反应,其能量值为____。
(4)反应物总能量___(填“>”或“<”)生成物总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2Na2CO3·3H2O2)晶体性质具有Na2CO3和H2O2 的双重性,被广泛用于氧气发生、漂白杀菌、污水处理、金属表面处理以及高分子聚合控制等。
(1)Na 原子的核外电子排布式为_____,O 原子核外 L 层上有_______种能量不同的电子,H2O2 的电子式是_____________________________________________
(2)设计一个简单实验,比较O 元素与其同主族短周期元素的非金属性强弱(简要写出实验方法、实验现象和结论)_____;并用原子结构知识对作出的结论进行解释_____。
(3)用一个离子方程式表示过碳酸钠溶液显碱性的原因________________________。
(4)高锰酸根离子(![]() )水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下:
)水对人体危害极大,可用过碳酸钠改性赤泥进行处理,反应如下:
_____![]() +_______CO
+_______CO![]() +___H2O2→___MnCO3+___□+____OH-+____H2O
+___H2O2→___MnCO3+___□+____OH-+____H2O
补全并配平上述化学反应过程式_____;反应中,过碳酸钠起沉淀剂和_________剂作用;若将 1L 含Mn 2000mg·L-1 的含高锰酸根离子的废水处理至含Mn 1.2mg·L-1,则转移电子数为_____mol(保留 2 位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为应对全球气候变暖,科学家在综合利用 CO2 方面取得了不少研究成果。如用 CO2 合成重要化工原料 CH3OH,同时生成 CO,反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+Q1kJ(Q1>0),
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g)-Q2kJ(Q2>0)。
研究催化剂等外界条件对上述反应的影响,结果如图 1、图 2
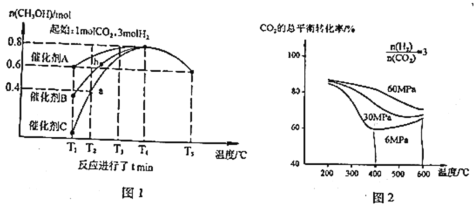
完成下列填空:
(1)一定是碳12的同位素原子是_____(选填“A”、“B”、“C”、“D”)
A.质子数为6,中子数为8 B.质子数为8,中子数为12
C.质子数为12,中子数为6 D.质子数为12,中子数为8
(2)分析图1:催化效果最佳的是催化剂_____(选填“A”、“B”、“C”)。若密闭容器体积为2L,则a点测得CH3OH的平均生成速率为_____mol·L-1·min-1。b点反应_____(填“达到”或“未达到”)平衡状态,理由是:_____
(3)分析图2:相同温度下,增大原料气压强,反应Ⅰ平衡常数_____(选填“增大”、“减小”、“不变”、“无法判断”);当压强为6Mpa、温度在400~600℃时,CO2的总体平衡转化率随温度升高而增大的原因是___________________________________
(4)若生成的CH3OH和CO物质的量之比为4:1,则消耗相同条件下的CO2和H2体积比是_____
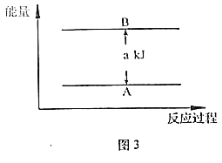
(5)若有88gCO2发生反应Ⅰ,并放出akJ热量,则图3中A为_____,B为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】面对新冠肺炎病毒可以采用的消毒剂常见的有“84”消毒液,医用酒精它们的有效成分分别是NaClO、![]() ,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
,都可以使病毒中的蛋白质变性,从而杀死病毒。请回答以下问题:
(1)以上涉及元素包含______个主族、______个周期;按原子半径由小到大排列依次为____________(用元素符号表示);有2个未成对电子元素是______;非金属性:O>Cl,请列举一个事实________________________。
(2)![]() 是______(“电解质”,“非电解质”);75%酒精的“75%”是______(“质量分数分数”,“体积分数”),
是______(“电解质”,“非电解质”);75%酒精的“75%”是______(“质量分数分数”,“体积分数”),![]() 分子中的氢原子的类型有______种(“2”,“3”或“4”)。
分子中的氢原子的类型有______种(“2”,“3”或“4”)。
(3)NaClO的电子式______,其溶液中的离子浓度由大到小顺序__________________。某化学工作者在家自制“84”消毒液如图

(4)①M的化学式______,铁是______极;②请阐述该装置能够制取消毒液的理由:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
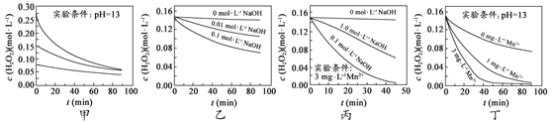
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com