
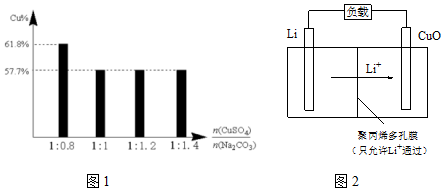
分析 (1)失电子的物质为负极;
(2)根据金属的相对原子质量和失电子数目判断;
(3)①Cu元素的化合价升高,O元素的化合价降低;
②硫酸铜与碳酸钠溶液反应生成Cu2(OH)2CO3;
③Cu2(OH)2CO3中铜元素的百分含量为57.7%,二者比值为1:0.8时,Cu元素的百分含量大于57.1%,可能不含C;
④Cu2(OH)2CO3加热分解生成CuO;
(4)由Li+的移动方向可知,CuO为正极,发生还原反应.
解答 解:(1)Li-CuO电池中,Li失去电子,金属锂做负极,故答案为:负;
(2)比能量是指消耗单位质量的电极所释放的电量,设质量均为m,则$\frac{m}{7}$>$\frac{m}{27}×3$>$\frac{m}{23}$,则Li、Na、Al分别作为电极时比能量的大小为Li>Al>Na,
故答案为:Li>Al>Na;
(3)①Cu元素的化合价升高,O元素的化合价降低,则H2O2的作用是氧化剂,故答案为:氧化剂;
②过程Ⅱ产生Cu2(OH)2CO3的离子方程式是2Cu2++2CO32-+H2O═Cu2(OH)2CO3↓+CO2↑,故答案为:2Cu2++2CO32-+H2O═Cu2(OH)2CO3↓+CO2↑;
③Cu2(OH)2CO3中铜元素的百分含量为57.7%,二者比值为1:0.8时,Cu元素的百分含量大于57.1%,可能不含C,则产品中可能含有的杂质是Cu(OH)2,因当Na2CO3用量减少时,c(CO32-)变小,CO32-水解程度变大,c(OH-)/c(CO32-)增加,c(OH-)对产物的影响增大,
故答案为:Cu(OH)2;当Na2CO3用量减少时,c(CO32-)变小,CO32-水解程度变大,c(OH-)/c(CO32-)增加,c(OH-)对产物的影响增大;
④过程Ⅲ反应的化学方程式是Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O,故答案为:Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2↑+H2O;
(4)由Li+的移动方向可知,CuO为正极,发生还原反应,则正极反应为CuO+2e-+2Li+═Cu+Li2O,故答案为:CuO+2e-+2Li+═Cu+Li2O.
点评 本题考查物质的制备实验及原电池,为高频考点,把握制备流程中发生的反应、原电池工作原理为解答的关键,侧重分析与应用能力的考查,注意(3)为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 32g O2所含的原子数目为2NA | |
| B. | 0.5NA个氯气分子的物质的量是0.5mol | |
| C. | 在标准状况下,22.4 L CH4与18 g H2O所含有电子数均为10NA | |
| D. | 22.4 L的CO气体与1 mol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONH4?CH3COO-+NH4+ | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaHSO4═Na++HSO4- | D. | CH3COOH?CH3COO-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 熔点由高到低:Na>Mg>Al | |
| C. | 沸点:水>碲化氢>硒化氢 | |
| D. | 晶格能由大到小:MgO>CaO>NaF>NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
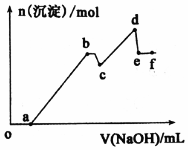 已知25℃时,Ksp[Mg(OH)2]=5.61×l0-12,Ksp[Al(OH)3]=1.3×l0-33,Al(OH)3?AlO2-+H++H2O Ka=6.31×l0-13.某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子.向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关说法正确的是( )
已知25℃时,Ksp[Mg(OH)2]=5.61×l0-12,Ksp[Al(OH)3]=1.3×l0-33,Al(OH)3?AlO2-+H++H2O Ka=6.31×l0-13.某溶液中可能含有 H+、Na+、Mg2+、Al3+、Cl-、HCO3-等离子.向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关说法正确的是( )| A. | b 点沉淀-Al(OH)3;d 点沉淀-A1(OH)3和Mg(OH)2;e点溶质-NaA1O2 | |
| B. | 依据题意,用NaOH不能完全分离Mg2+和Al3+离子 | |
| C. | cd 段发生的反应为:Mg2++2OH-=Mg(OH)2↓ | |
| D. | bc 段发生的反应为:Al(OH)3+OH-=A1O2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
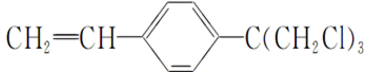
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是纤维素,属于天然高分子化合物 | |
| B. | 陶瓷、水泥和玻璃都属于硅酸盐产品 | |
| C. | 废旧钢材焊接前,可依次用饱和Na2CO3溶液、饱和NH4Cl溶液处理焊点 | |
| D. | 使用可降解的聚碳酸酯塑料和向燃煤中加入生石灰,都能减轻环境污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com