
(1)①BF3与一定量的水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
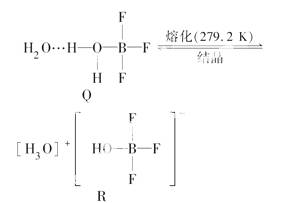
晶体Q中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②已知苯酚具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子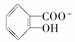 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是__________________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是__________________。
(2)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/ (kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是_________________。
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应式为:2Cl—-2e—==Cl2↑
B.明矾净水时,主要反应的离子方程式为: Al3++3H2O==Al(OH)3 ↓+3H+
C.氢硫 酸的电离方程式为:H2S
酸的电离方程式为:H2S  2H++S2—
2H++S2—
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e— Fe2+
Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料)。
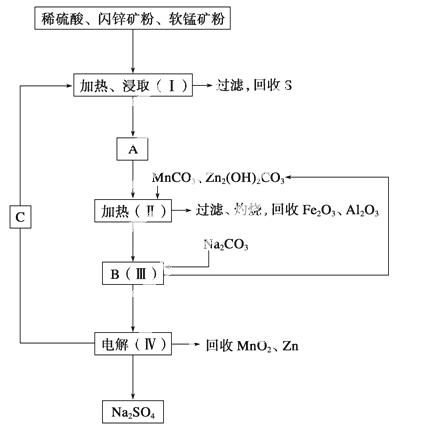
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②Ⅳ中电解方程式为MnSO4+ZnSO4+2H2OMnO2+Zn+2H2SO4。
(1)A中属于还原产物的是______ ____。
____。
(2)加入MnCO3、Zn2(OH)2CO3的作用是_____________________________________
________________________________________________________________________。
Ⅱ需要加热的原因是____________________________________________________。
C的化学式是________________________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是________。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是________。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、________、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。请回答下列问题:
(1)目前,以下“技术”中,可用于“海水淡化”的是___________________________
(填序号)。
①蒸馏法 ②膜分离法(电渗析、反渗透) ③冷冻法 ④离子交换法
(2)海 水晒盐利用的化学原理是____________________________________________;
水晒盐利用的化学原理是____________________________________________;
分离食盐晶体后的母液中含有____________,经过分离、提纯后,可用于_________。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应的 离子方程式为________________________________________________________________________;
离子方程式为________________________________________________________________________;
电解所用的食盐水需要精制,其原因是_____________________________________
________________________________________________________________________;
精制时所用试剂:盐酸、BaCl2溶液、NaOH溶液、Na2CO3溶液,加入试剂时,Na2CO3溶液必须在加入__________________________________________________________之后加入。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫的废气同时回收二氧化硫的方法,该方法的流程如下:
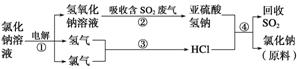
写出反应②、④的化学方程式:_____________________________________________、
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氯化铝的熔点为190 ℃(2.02×106 Pa),但它在180 ℃即开始升华。
(1)氯化铝是________(填“离子晶体”或“分子晶体”)。
(2)在500 K和1.01×105 Pa时,它的蒸气密度(换算成标准状况时)为11.92 g·L-1,试确定氯化铝在蒸气状态的化学式为________,微粒间的作用力类型有________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是______________________。
(4)设计一个更可靠的实验,判断氯化铝是离子晶体还是分子晶体,你设计的实验是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
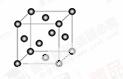
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;1mol乙醛分子中含有ó的键的数目为 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为 。
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________________________(用对应的元素符号表示);基态D原子的电子排布式为
______________________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。
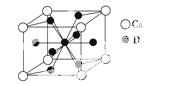
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com