
| A. | [ZnCl4]2-空间构型呈平面四边形 | |
| B. | [ZnCl4]2-空间构型呈正四面体形 | |
| C. | [ZnCl4]2-离子中存在2个σ键和2个π键 | |
| D. | [ZnCl3F]2-不存在着同分异构体 |
分析 Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,[ZnCl4]2-中的配位数是4,据此分析.
解答 解:A.Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,空间构型呈正四面体形,故A错误:
B.Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,空间构型呈正四面体形,故B正确;
C.Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,存在4个σ键,没有π键,故C错误;
D.[ZnCl3F]2-的结构为四面体结构,结构类似甲烷,所以不存在同分异构体,故D正确.
故选BD.
点评 本题考查了离子空间构型的判断,难度中等,根据中心原子的杂化方式结合配位数判断即可,侧重于考查学生对基础知识的应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

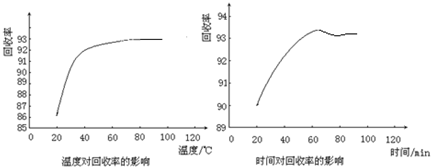
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移溶液时,没有洗涤玻璃棒和溶解用的烧杯 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 定容时观察液面俯视 | |
| D. | 胶头滴管加水定容时,有少量水滴到容量瓶外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
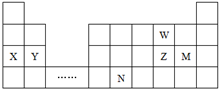
| A. | 离子半径:W2->Y2+ | |
| B. | 电解X与Z形成的化合物的水溶液,不能得到X单质 | |
| C. | 碘的氢化物酸性比M的氢化物酸性弱 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成1 mol N2,电子转移总数为3NA | B. | 生成1 mol N2,电子转移总数为5NA | ||
| C. | 溶解1 mol Zn,电子转移总数为2NA | D. | 溶解1 mol Zn,电子转移总数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| H2 | HCl | Cl2 | ClF |
| 两个原子的s轨道重叠 | 氢原子的s轨道和氯原子的p轨道重叠 | 一个氯原子的s轨道和另一个氯原子的p轨道重叠 | 氯原子的p轨道和氟原子的p轨道重叠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
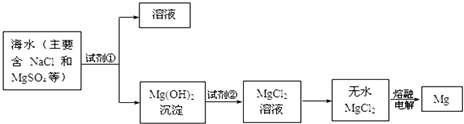
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com