
| CH3COOH | HC1O | H2CO3 |
| Ka=1.8×l0-5 | Ka=3.0×l0-8 | Ka1=4.4×l0-7Ka2=4.7×l0-11 |
| A. | 向NaClO溶液中通入少量CO2的离子方程式为:2C1O-+CO2+H2O═2HC1O+CO32- | |
| B. | 相同浓度的CH3COOH和NaClO的混合溶液中,水的电离程度前者大 | |
| C. | 向0.lmol•L-l的CH3COOH溶液中滴加NaOH溶液至pH=5,此时溶液的 c(CH3COOH):c(CH3COO-)=5:9 | |
| D. | 常温下,0•lmol•L-1 的 NaHC2O4 溶液 pH=4:c(HC2O4-)>c(H+)>c(H2C2O4)>c(C2O42-) |
分析 A.强酸制取弱酸判断,CH3COOH>H2CO3>HC1O>HCO3-;
B.酸碱抑制水的电离,水解的盐促进水的电离;
C.电离常数计算分析;
D.常温下,0•lmol•L-1 的 NaHC2O4 溶液 pH=4,溶液显酸性,溶液中酸根离子电离程度大于其水解程度.
解答 解:A.酸的二级电离小于次氯酸,所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O═HClO+HCO3-,故A错误;
B.相同浓度的CH3COOH和NaClO的混合溶液中,水的电离程度后者大,故B错误;
C.CH3COOH溶液中$\frac{c({H}^{+})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=1.8×10-5,c(CH3COOH):c(CH3COO-)=5:9,则c(H+)=1×10-5mol/L,则pH=5,故C正确;
D.常温下,0•lmol•L-1 的 NaHC2O4 溶液 pH=4,溶液显酸性,溶液中酸根离子电离程度大于其水解程度,离子浓度大小为:c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4),故D错误;
故选C.
点评 本题考查电解质的强弱与电离常数的关系,侧重于学生的分析能力和计算能力的考查,明确酸的电离常数与酸的强弱、酸根离子水解能力的关系是解本题关键,难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:填空题
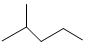 表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.
表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.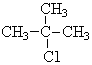 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol氢气含有的原子数为NA | |
| B. | NA个水分子中含有氢原子的物质的量为2 mol | |
| C. | 1 mol 氧气中含有的分子数为2NA | |
| D. | 1 mol任何物质都含有NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | Cl-Cl | O=O | O-H | H-Cl |
| 键能(kJ.mol-1) | 247 | 498 | 463 | 431 |
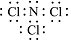 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1 CaCl2溶液等体积混合:c(Na+)+c(Ca2+)═c(CH3COO-)+c(CH3COOH)+c(Cl-) | |
| B. | 少量Cl2通入过量泠的0.1 mol•L-1 NaOH溶液中:c(Na+)═c(HClO)+c(ClO-)+c(Cl-) | |
| C. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1 HCl溶液混合至pH=7:c(Na+)>c(Cl-)═c(CH3COOH) | |
| D. | 0.2 mol•L-1 NH3•H2O溶液与0.1 mol•L-1 HCl溶液等体积混合:c(Cl-)+c(H+)═c(NH3•H2O)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 加入足量铜粉、搅拌、过滤 | 除去CuCl2溶液中少量的FeCl3 |
| B | 在NaHCO3溶液中滴加H2C2O4溶液 | 比较H2C2O2与H2CO3的酸性强弱 |
| C | 将气体通入AgNO3溶液 | 检验H2S气体中存在HCl杂质 |
| D | 在坩埚中加热至恒重 | 除去BaSO4中少量的BaSO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚沾在皮肤上用大量水冲洗 | |
| B. | 金属钠着火时,立即用沙子盖灭 | |
| C. | 制备氯气时,应用NaOH溶液吸收多余的氯气 | |
| D. | 制备乙烯时向乙醇和浓硫酸的混合液中加碎瓷片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com