
【题目】按要求完成下列各题。
(1)FeCl3溶液中加入KSCN呈红色,写出离子方程式_________________________。
(2)NaHCO3溶液显碱性的原因_________________________。
(3)NH4Cl溶液加入锌粒产生气体的离子方程式_________________________。
(4)已知16克固体硫充分燃烧放出148.4kJ的热量,则该反应的热化学方程式为_____________。
【答案】 Fe3++3SCN-![]() Fe(SCN)3 HCO3-+H2O
Fe(SCN)3 HCO3-+H2O![]() H2CO3+OH- 2NH4++Zn=2NH3↑+H2↑+Zn2+ S(s)+O2(g)=SO2(g) ΔH=-296.8kJ/mol
H2CO3+OH- 2NH4++Zn=2NH3↑+H2↑+Zn2+ S(s)+O2(g)=SO2(g) ΔH=-296.8kJ/mol
【解析】(1)FeCl3溶液中加入KSCN呈红色,反应的离子方程式为Fe3++3SCN-![]() Fe(SCN)3,故答案为:Fe3++3SCN-
Fe(SCN)3,故答案为:Fe3++3SCN-![]() Fe(SCN)3;
Fe(SCN)3;
(2)碳酸氢根离子在水溶液里电离程度小于水解程度而导致溶液呈碱性,水解的方程式为HCO3-+H2O![]() H2CO3+OH-,故答案为:HCO3-+H2O
H2CO3+OH-,故答案为:HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
(3)NH4Cl溶液水解显酸性,加入锌粒生成氢气,同时促进铵根离子水解放出氨气,反应的离子方程式为2NH4++Zn=2NH 3↑+H2↑+Zn2+,故答案为:2NH4++Zn=2NH 3↑+H2↑+Zn2+;
(4)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出296.8kJ热量,则热化学方程式为:S(s)+O2(g)=SO2(g);△H=-296.8kJ/mol,故答案为:S(s)+O2(g)=SO2(g);△H=-296.8kJ/mol。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】《中华人民共和国大气污染防治法》于2016年1月1日起实施。为保护和改善大气环境,下列做法不应该提倡的是
A. 开发生物质能替代化石燃料 B. 向高空排放金属冶炼产生的粉尘
C. 用催化转化技术处理汽车尾气 D. 大力推广生产和使用无氟冰箱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572KJ的热量,则表示H2的燃烧热的热化学方程式为_________
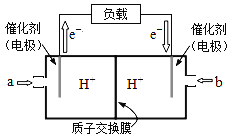
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图放电时甲醇应从____处通入(填“a”或“b”).电池内部H+向______(填“左”或“右”)移动。写出电池负极的电极反应式_____。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.已知:N2(g)+3H2(g)=2NH3(g)ΔH=-93kJ/mol,试根据表中所列键能数据计算a的数值__________。
化学键 | H-H | N-H | N≡N |
键能/kJmol | 436 | a | 945 |
当可逆反应中净生成N-H物质的量为2mol时,反应放热________
(4) 已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJmol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJmol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJmol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对 ![]() X与
X与 ![]() X+两种微粒,下列叙述正确的是( )
X+两种微粒,下列叙述正确的是( )
A.一定都是由质子、中子、电子组成的
B.质子数一定相同,质量数和中子数一定不相同
C.核电荷数和核外电子数一定相等
D.化学性质几乎完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积为1 L的密闭容器中发生可逆反应:Fe(s)+H2O(g) ![]() FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
FeO(s)+H2(g) ΔH>0。在1 000℃时,H2O(g)的平衡转化率(α)与体系总压强(p)关系如图所示。
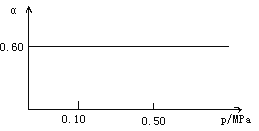
(1)写出该反应的平衡常数表达式K=__________。当反应达到平衡后,再向容器中加入铁粉和水蒸气,则K__________,(填“增大”、“减小”或“不变”,下同);升高温度,则K__________。
(2)在1 000℃时,若向上述容器中加入0.80 mol铁粉和1.00 mol水蒸气,达到平衡时,容器中c(H2)=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2xH2O,工艺流程如下图所示。
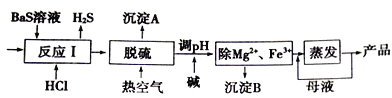
已知: 室温时Ksp[Mg(OH)2]= 1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38,请回答下列问题:
(1)写出氯化钡的电子式______,盐酸和硫化钡反应的化学方程式为___________。
(2)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为_______________________。
(3)沉淀A的成分是__________。
(4)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________________。
(5)室温时,若加碱调溶液pH至9,则完全沉淀的离子是_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1mol·L-1 KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写) 。
(2)上述(B)操作的目的是 。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同) 。
(4)实验中用左手控制 (填仪器及部位),眼睛注视 ,直至滴定终点。判断到达终点的现象是 。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是 。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 糖类、油脂、蛋白质都能发生水解反应
B. 乙酸、葡萄糖在一定条件下均能与Cu(OH)2反应
C. 纤维素、淀粉的化学式都可用(C6H10O5)n表示,它们互为同分异构体
D. 木材纤维和土豆淀粉遇碘水均显蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质有以下性质:①是电解质 ②溶解时有化学键的破坏 ③熔化时没有化学键的破坏,则该物质固态时属于
A. 原子晶体 B. 离子晶体 C. 分子晶体 D. 金属晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com