
分析 (1)淀粉遇到单质碘变蓝色;根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(2)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对相关物理量的影响,以此判断浓度的误差;
(3)求出硫代硫酸钠的质量,样品中硫代硫酸钠纯度=$\frac{m(Na{\;}_{2}S{\;}_{2}O{\;}_{3})}{m(样品)}$×100%.
解答 解:(1)淀粉遇到单质碘变蓝色,滴定前可以选择淀粉做指示剂,滴定终点的现象为溶液刚好出现蓝色,且半分钟不褪去;
故答案为:淀粉;溶液刚好出现蓝色,且半分钟不褪去;
(2)A.滴定前,对锥形瓶进行润洗,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故A错误;
B.滴定过程中,标准液滴到锥形瓶外,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故B正确;
C.滴定管在滴定开始时尖嘴有气泡,滴定完成后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,待测液的物质的量偏大,则所测得的纯度将会偏大,故C错误;
D.滴定前仰视读数而滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏低,待测液的物质的量偏低,则所测得的纯度将会偏小,故D正确;
故选BD;
(3)根据I2+2Na2S2O3=Na2S4O6+2NaI,n(I2)=amol/L×b×10-3L,知消耗的Na2S2O3的物质的量=2n(I2)=2amol/L×b×10-3L,根据现称取Wg硫代硫酸钠固体样品配成250mL的溶液,取25.00mL置于锥形瓶中,则被滴定的硫代硫酸钠质量为$\frac{1}{10}$Wg,故样品中硫代硫酸钠纯度的表达式为$\frac{2amol/L×b×10{\;}^{-3}L×158g/mol}{\frac{1}{10}wg}$×100%=$\frac{3.16ab}{w}$×100%;
故答案为:$\frac{3.16ab}{w}$×100%.
点评 本题考查了物质百分含量的探究,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
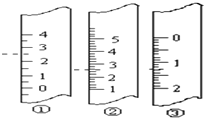 某同学用0.10mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
某同学用0.10mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
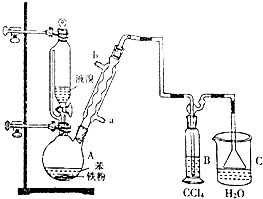
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的电子排布图: | B. | Na+的结构示意图: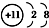 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化电子排布式:[Ne]3s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能加快反应速率,使N2完全转化为NH3 | |
| B. | 当N2、H2、NH3浓度相等时,反应达到化学平衡状态 | |
| C. | 一段时间后,当N2、H2、NH3浓度不再改变时,反应物转化率最大 | |
| D. | 达平衡后,升高温度,反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com