
分析 跟金属铝反应生成H2的溶液可能为酸溶液,也可能为碱溶液,当生成Al3+时,溶液为酸溶液,当生成[Al(OH)4]-时,溶液为碱溶液,然后利用离子的共存的条件进行解答.
解答 解:离子均为无色,所有离子均与无色透明溶液符合;铝既能与酸作用产生氢气,也能与碱作用产生氢气,
(1)溶液和铝粉反应后有[Al(OH)4]-生成,溶液显碱性,Mg2+、H+、Ag+、HCO3-不能存在,根据溶液不显电性,一定存在阳离子,即阳离子只有Na+,说明原溶液中的阴离子一定含OH-,可能含NO3-、Cl-,
故答案为:Na+、OH-;NO3-、Cl-;
(2)溶液和铝粉反应后有Al3+生成,溶液显酸性,则HCO3-、OH-不存在,由于硝酸与金属反应一般没有氢气产生,因此也不存在NO3-,根据溶液不显电性,一定存在阴离子,即溶液中肯定有Cl-,而Ag+可与Cl-生成沉淀,说明原溶液中也不存在Ag+,即溶液中一定含有大量的H+、Cl-,可能含Na+、Mg2+,一定不能含有的离子为:Ag+、OH-、HCO3-、NO3-,
故答案为:Ag+、OH-、HCO3-、NO3-.
点评 本题考查物质的检验及离子的共存问题,明确常见离子之间的反应是解答本题的关键,并注意利用溶液为电中性、溶液的酸碱性等来分析解答即可,题目难度不大.


科目:高中化学 来源: 题型:解答题

 +H2O(R、R′为H或烃基)
+H2O(R、R′为H或烃基)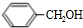 ;C中含有的官能团碳碳双键和醛基(写名称).
;C中含有的官能团碳碳双键和醛基(写名称). .
. .
.


查看答案和解析>>
科目:高中化学 来源: 题型:推断题
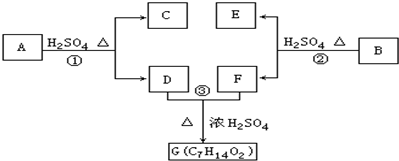
 ;
;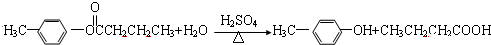 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑦ | B. | ③④⑤⑦⑨ | C. | ①③⑤⑦⑨ | D. | ①③④⑦⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后得到的上层清液,加入2滴K4[Fe(CN)6](亚铁氰化钾)溶液 | 若产生暗蓝色沉淀,则猜想一不成立. |
| 步骤二:取探究Ⅲ中所得溶液,加入少量乙醚,充分振荡,静置分层 | 若乙醚层呈红色,则猜想二成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
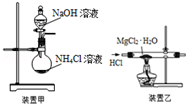
| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 使用分液漏斗和容量瓶时,首先要查是否漏水 | |
| C. | 实验室用装置甲制取NH3 | |
| D. | 用装置乙制取无水MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内原子总数不变 | B. | 容器内压强不变 | ||
| C. | 容器内分子总数不变 | D. | 发生的反应属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| A | B |
| ①能使溴的四氯化碳溶液褪色; ②比例模型:  ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为  |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,其中含有的化学键类型为离子键、共价键.
,其中含有的化学键类型为离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com