
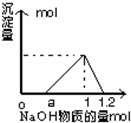
 往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )
往Al2(SO4)3与H2SO4混合溶液中逐滴加入NaOH溶液,所得沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则Al2(SO4)3与H2SO4的物质的量浓度之比为( )| A. | 1:3 | B. | 1:4 | C. | 1:1 | D. | 1:2 |
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:推断题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1mol CO、2mol H2 | 1mo l CH3OH | 2mol CH3OH | |
| 平衡时数据 | CH3OH的 浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | b kJ | c kJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L CuCl2溶液中含有的Cl-的个数为2NA | |
| B. | 16 g甲烷中含有的共用电子对数为NA | |
| C. | 常温常压,46 gNO2与N2O4的混合气体中含有的原子数为3NA | |
| D. | 4.6 g Na与适量氧气完全反应生成Na2O、Na2O2的混合物中含有的阴离子数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2+HCl $→_{△}^{催化剂}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| C. | 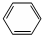 +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$ 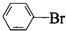 +HBr +HBr | |
| D. | CH3CH2 Br+NaOH $→_{△}^{乙醇}$ CH2=CH2↑+Na Br+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | B. | 原子序数 D>C>B>A | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | ① | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | / | Zn+Fe2+=Zn2++Fe | ② |
| ③ | 在FeCl3溶液中加入足量铁粉 | ③ | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | ④ | / | / | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价含氧酸的酸性最强的元素位于周期表的最右上方 | |
| B. | 所有主族元素的最高正化合价等于它的族序数 | |
| C. | X的含氧酸的酸性比Y的含氧酸的酸性强,则非金属性X>Y | |
| D. | 离子化合物熔融状态都能导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com