
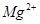 、
、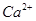 、
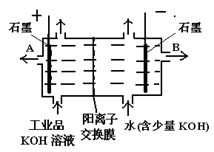
、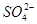 等杂质)配制的食盐水,以下说法正确的是
等杂质)配制的食盐水,以下说法正确的是
| A.a是电解池的正极 | B.a电极上发生还原反应 |
| C.b电极附近有白色沉淀出现 | D.b电极上有黄绿色气体产生 |
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝是阳极,铁是阴极 |
| B.使用NaHCO3溶液作为电解液,能减缓阴极区的pH增大 |
| C.电解液必须保持pH的相当稳定 |
| D.该电解过程中阳极反应式是:Al-3e-=Al3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
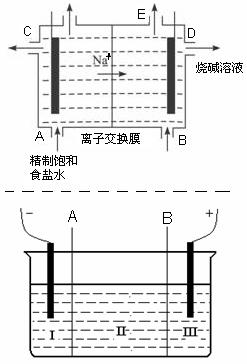
| A.从E口逸出的气体是H2 |
| B.从B口加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH |
| D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 ②假设二: 。
②假设二: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

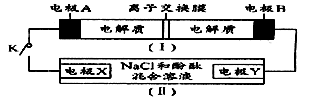
| A.闭合K时,X+从右到左通过离子交换膜 |
| B.闭合K时,负极反应为3XW-2e-=XW3+2X+ |
| C.闭合K时,X电极的电极反应为2Cl-2e-=Cl2↑ |
D.闭合K时,当有0.1mol X+通过离子交换膜,X电极 上析出标准状况下气体1 上析出标准状况下气体1 .12L .12L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.保护地下钢管不受腐蚀,可使它与直流电源负极相连 |
| B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上电镀铜时可用金属铜作阴极 |
| D.电解稀硫酸制氢气、氧气时可用铜作阳极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
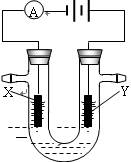
 池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则:
池,电解液ɑ是足量的饱和NaCl溶液,X、Y都是石墨电极,实验开始前,在两边各滴入几滴酚酞试液,则: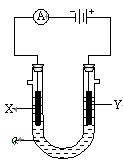
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com