
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如图:
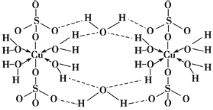
下列有关胆矾的说法正确的是( )
A.Cu2+的电子排布式为[Ar]3d84s1
B.所有氧原子都采取sp3杂化
C.氧原子参与形成离子键、配位键和氢键三种化学键
D.因为作用力的不同,胆矾中的水在不同温度下会分步失去
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
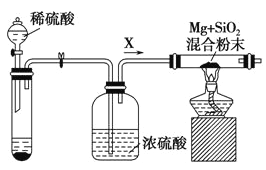
(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氢氧燃烧电池原理示意图,按照此图的提示,下列叙述正确的是( )
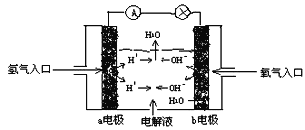
A. a电极是正极
B. b电极的电极反应为:4OH-- 4e-=2H2O + O2↑
C. 电子从a电极经由电解液传递到b电极
D. 氢氧燃烧电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:
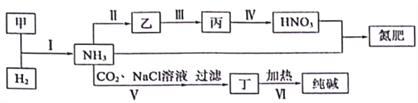
下列说法不正确的是( )
A. 反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均属于氧化还原反应
B. 上述转化中包含了氨气、硝酸、硝铵、小苏打、纯碱的工业生产方法
C. 反应Ⅳ和Ⅵ中的部分产物可在上述流程中循环利用
D. 反应V是先向饱和氯化钠溶液中通CO2至饱和再通NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
A. 合理处理废铅蓄电池有利于资源再利用和防止重金属污染
B. 步骤①中可用浓硫酸代替浓盐酸
C. 步骤①、②、③中均涉及过滤操作
D. PbSO4(s)+2Cl-(aq)![]() PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精灯给试管里的物质加热时,发现试管破裂可能的原因有:①用酒精灯的外焰加热;②加热时试管外壁的水没有擦干;③加热时试管底部接触灯芯;④被加热的液体超过试管容积的![]() ;⑤加热液体时没有不时的上下移动试管;⑥没有进行预热,直接集中加热试管里的物质;⑦加热固体时试管口向上倾斜。其中与之相关的是( )
;⑤加热液体时没有不时的上下移动试管;⑥没有进行预热,直接集中加热试管里的物质;⑦加热固体时试管口向上倾斜。其中与之相关的是( )
A.②③⑤⑦B.②④⑤⑥C.②③⑥⑦D.①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
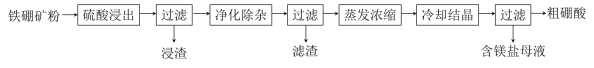
已知:硼酸为粉末状晶体,易溶于水,加热到一定温度可分解为无水物。
回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式___。为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有(写两条):___。
(2)“浸渣”中还剩余的物质是:___(写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是___。然后再调节溶液的pH约为5,目的是___。
(4)“粗硼酸”中的主要杂质是___(填名称)。
(5)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为初中常见实验仪器,按要求回答问题:
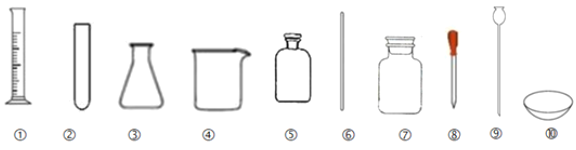
(1)指出仪器③的名称:__;为方便向密封容器中随时添加液体药品,常选用的仪器是___(填名称)。
(2)盛放固体药品,应用仪器__(填序号)。
(3)能够直接加热的仪器有__(填序号)。
(4)溶解较多量的食盐应选用的仪器④和⑥,其中仪器⑥在此实验中的作用是__。
(5)量取18mL水应选用的仪器___(填序号),读数时视线要与液体__;将18mL水倒出来一些后仰视读数是10mL,倒出来的实际体积___(“大于”或“小于”)8mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com