
分析 ①根据步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作选取实验仪器;
②计算配制100ml1.00mol•L-1的NaOH溶液所需人氢氧化钠的质量.
解答 解:①实验室要用90mL 1.00mol•L-1的NaOH溶液,需要配制100ml1.00mol•L-1的NaOH溶液,然后量取出90ml;配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,分析可知还要使用的仪器有100 ②容量瓶,
故答案为:100 mL容量瓶;
②实验室要用90mL 1.00mol•L-1的NaOH溶液,需要配制100ml1.00mol•L-1的NaOH溶液,然后量取出90ml,需用托盘天平称取NaOH的质量=0.100L×1.00mol•L-1×40g/mol=4.0g,
故答案为:4.0.
点评 本题考查了一定物质的量浓度溶液的配制以及误差分析,难度不大,注意实验的基本操作方法和注意事项.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NA个HCl分子与44.8 L H2和Cl2的混合气体所含的原子数目均为4NA | |
| B. | 32gCu将足量浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA | |
| C. | 物质的量浓度均为1mol/L的NaCl和MgCl2混合溶液中,含有Cl-的数目为3NA | |
| D. | 1molD3${\;}_{\;}^{18}$O+(其中D代表${\;}_{1}^{2}$H)中含有的中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
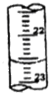 某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ③⑤⑥⑦ | C. | ①③④⑥ | D. | ②③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgI悬浊液中存在平衡:AgI(s)?Ag+(aq)+I-(aq) | |
| B. | 25℃时,向AgCl的悬浊液中加入NaCl固体,AgCl的溶度积常数不变 | |
| C. | 向含KCl、NaI的混合溶液中滴入AgNO3溶液,一定先析出AgI沉淀 | |
| D. | 用等体积的水和氯化钠溶液分别洗涤AgCl沉淀,水洗造成的AgCl损耗大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中查得的相对原子质量为同使素的相对原子质量 | |
| B. | 化学键的变化一定会引起化学反应的变化 | |
| C. | 酸性氧化物一定是非金属氧化物 | |
| D. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
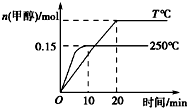 将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol,根据图示判断,下列结论正确的是( )
将1mol CO和2mol H2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol,根据图示判断,下列结论正确的是( )| A. | a<0,T<250 | |
| B. | 250℃时,0~10 min内v(H2)=0.015 mol/(L•min) | |
| C. | CO的平衡转化率在250℃时比T℃时大 | |
| D. | 250℃时,起始时向容器中改充1 mol CH3OH气体,恒温达平衡后,CH3OH的物质的量大于0.15 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com