
分析 (1)根据所给的反应,通过加减乘除等变化得到所要求的反应,反应热也做相应的变化即可;
(2)根据水的电离并结合题目所给的信息来分析;
(3)实验室用Pt电极对液氨进行电解可以得到H2和N2,则阳极收集到的气体为N2,求出氮气的物质的量,然后根据电解时氮元素的价态由-3价变为0价来分析转移的电子的数目;根据电解时阴阳两极上得失电子数相等,可求出阴极上失去的电子的物质的量,然后根据阴极上当转移2mol电子时,生成1mol氢气来分析所得气体的物质的量和质量.
解答 解:(1)已知:①2NH3(g)?N2 (g)+3H2(g)△H=+a kJ•mol-1
②2H2(g)+O2 (g)═2H2O(l)△H=-b kJ•mol-1
③NH3 (g)?NH3(l)△H=-c kJ•mol-1
将①×2+②×3-③×4可得:4NH3(l)+3O2 (g)═2N2(g)+6H2O(l)△H=(2a-3b+4c)KJ/mol,故答案为:2a-3b+4c;
(2)液氨类似于水的电离,已知水的电离方程式可写为2H2O?H3O++OH-,则液氨的电离方程式为2NH3?NH4++NH2-,故答案为:2NH3?NH4++NH2-;
(3)实验室用Pt电极对液氨进行电解可以得到H2和N2,则阳极收集到的气体为N2,标况下4.48L氮气的物质的量为0.2mol,而电解时氮元素的价态由-3价变为0价,故当生成0.2mol氮气时转移0.2mol×6=1.2mol电子,即1.2NA个电子;根据电解时阴阳两极上得失电子数相等,故阴极上得到的电子的物质的量为1.2mol,而阴极上当转移2mol电子时,生成1mol氢气,故当阴极上得到1.2mol电子时,生成0.6mol氢气,质量m=nM=0.6mol×2g/mol=1.2g,故答案为:1.2NA;1.2.
点评 本题考查了盖斯定律的应用和电解池中根据得失电子数守恒来解题,难度不大,是高考中常考的题型.


科目:高中化学 来源: 题型:多选题
| A. | 分别取两种固体样品,加热产生气体的是碳酸氢钠 | |
| B. | 分别取样溶于水后加入氯化钙溶液,若有白色沉淀则是碳酸钠 | |
| C. | 分别取样溶于水后加入澄清石灰水,若有白色沉淀则是碳酸钠 | |
| D. | 分别取等质量的两种固体样品,与足量的硫酸反应,产生气体较多的是碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制硫酸时用到的主要设备有沸腾炉、接触室、吸收塔 | |
| B. | 可用KSCN溶液检验某溶液中是否存在Fe3+ | |
| C. | 相同条件下同体积同浓度的盐酸分别与等质量的碳酸钠、碳酸氢钠固体反应,后者速率快 | |
| D. | 铝粉可与氧化镁在高温下发生铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度可以增大活化分子百分数,从而使反应速率增大 | |
| B. | 汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能 | |
| C. | 在“反应热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度 | |
| D. | 研制性能优良的催化剂既可以提高化学反应速率,又能起到很好的节能效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
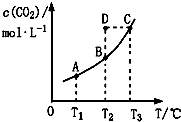
| A. | 该反应的△H<0 | |
| B. | 在T2时,D点的反应速率:ν(正)<(逆) | |
| C. | A、C两点相比,混合气体的平均相对分子质量:M(A)<M(C) | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、HCO3-、Br- | B. | SO32-、Al(OH)4-、K+、Al3+ | ||
| C. | Fe3+、Na+、NO3-、CO32- | D. | NH4+、Na+、SiO32-、I- | ||
| E. | Ca2+、Na+、NO3-、PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除④外都对 | B. | 除⑤外都对 | C. | ④⑤不对 | D. | 全都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com