
【题目】用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A. ![]() B.
B. ![]() C. n(H+) D. n(OH-)
C. n(H+) D. n(OH-)
【答案】A
【解析】
A、由NH3·H2OOH-+NH4+可知,加水促进电离,则n(NH3·H2O)减少,n(OH-)增大,因此![]() 减小,故A正确;B、由NH3·H2OOH-+NH4+可知,加水促进电离,则n(NH3·H2O)减少,n(OH-)增大,
减小,故A正确;B、由NH3·H2OOH-+NH4+可知,加水促进电离,则n(NH3·H2O)减少,n(OH-)增大,![]() 增大,故B错误;C、用水稀释0.1mol/L氨水时,溶液中随着水量的增加,由NH3·H2OOH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,温度不变,则c(H+)和c(OH-)的乘积不变,因此c(H+)增大,n(H+)增大,故C错误;D、氨水是弱碱,存在电离平衡,稀释促进电离,OH-的物质的量增加,故D错误;故选A。
增大,故B错误;C、用水稀释0.1mol/L氨水时,溶液中随着水量的增加,由NH3·H2OOH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,温度不变,则c(H+)和c(OH-)的乘积不变,因此c(H+)增大,n(H+)增大,故C错误;D、氨水是弱碱,存在电离平衡,稀释促进电离,OH-的物质的量增加,故D错误;故选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) +H2O(g) ![]() CO2(g) +H2 (g) △H<0,t℃时物质浓度(mol·L-1)的变化CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。
CO2(g) +H2 (g) △H<0,t℃时物质浓度(mol·L-1)的变化CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=_________mol·L-1·min-1。
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |

(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于_________状态; c 1数值_________0.08 mol·L-1 (填大于、小于或等于)
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________ (单选),表中5min~6min之间数值发生变化,可能的原因是_________ (单选)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数/K | 9.94 | 9 | 1 |
C(s)+CO2(g)![]() 2CO(g) K
2CO(g) K
C(s)+H2O(g)![]() CO(g)+H2(g) K1
CO(g)+H2(g) K1
CO(g)+H2O(g)![]() H2(g)+CO2(g) K2
H2(g)+CO2(g) K2
则K、K1、K2之间的关系是K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项是关于玻璃棒在若干实验中的用途及操作,其中不正确的是( )
A.溶解物质时搅拌
B.蘸取少量溶液做焰色试验
C.过滤时向漏斗中转移液体
D.配制一定物质的量浓度的溶液时引流
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液与300mL 0.1mol/L的KCl溶液中K+的浓度相同的是
A.150mL 0.2mol/L的KNO3溶液B.100mL 0.05mol/L的K2SO4溶液
C.100mL 0.1mol/L的K3PO4溶液D.100mL 0.3mol/L的KClO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、磷及其化合物是非常重要的物质。
(1)Cu+的电子排布式____;
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-。[Cu(CN)4]2-的配体为____,[Cu(CN)4]2-中C的杂化方式为____,则1个[Cu(CN)4]2-中含有的σ键的数目为____个;
(3)锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,不溶于水,可通过Na3PO4、CuSO4和NH3·H2O反应制取。制取Cu4O(PO4)2的化学方程式为____;
(4)PCl5中P-Cl键长有198pm和206pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,写出一种阳离子的等电子体的化学式____,PCl5的立体构型为____;
(5)金属铜属于面心立方晶体,铜的密度为ag·cm3,NA表示阿伏伽德罗常数,则铜的配位数____,铜的金属半径为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌-空气电池(原理如图)适宜用作城市电动车的动力电源,放电时Zn转化为ZnO。则该电池放电时下列说法正确的是()

A.将电能转化为化学能
B.氧气在石墨电极上发生氧化反应
C.电子由Zn电极经导线流向石墨电极
D.该电池放电时OH-向石墨电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL浓度均为0.10 mol/L的CH3COOH 溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
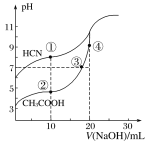
A. 室温下,电离平衡常数:K(HCN)>K(CH3COOH)
B. 点①和点②所示溶液中:c(CH3COO-)>c(CN-)
C. 点③所示的溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
D. 点④所示的溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素 A、B、C、D、E 的最高价氧化物对应的水化物分别为 X、Y、M、Z、W,B 是短周期主族元素中原子半径最大的元素,常温下 X、Y、Z、W 均可与 M 反应,A、B、D、E 的原子序数及其对应 0.1mol/L X、Y、Z 、W 溶液的 pH 如图所示。
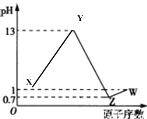
下列说法正确的是:
A. D的简单气态氢化物的热稳定性大于E的气态氢化物热稳定性
B. A、B、C 三种元素简单离子半径的大小顺序为C>B>A
C. Y 的稀溶液与 Z 或 W 的稀溶液分别发生中和反应时,对应的中和热在数值上相等
D. Y与W 两物质的化学键类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com