
 头滴管中可挤出0.50mL水。(不考虑溶质的损失)
头滴管中可挤出0.50mL水。(不考虑溶质的损失)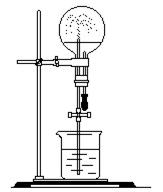
| 气体 | A | B | C | D | E |
| 溶解度(标况) | 2.6 | 40 | 5.8 | 10.2 | 23.1 |
科目:高中化学 来源:不详 题型:填空题
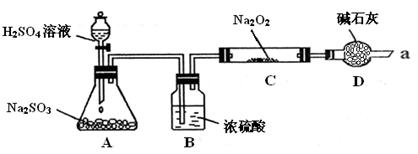
 L-1BaCl2、2mol
L-1BaCl2、2mol L-1HNO3
L-1HNO3| 实验步骤 | 预期现象和结论 |
 步骤1:分别取少量反应后C中的固体置于A、B试管中。 步骤1:分别取少量反应后C中的固体置于A、B试管中。 | |
| 步骤2: | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
| A.NaHCO3的溶解是吸热过程 |
| B.NaHCO3的饱和溶液和盐酸的反应是吸热反应 |
| C.Na2CO3的溶解是放热过程 |
| D.Na2CO3的饱和溶液和盐酸的反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
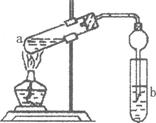

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 | 待测草酸溶液体积(mL) | 滴定开始读数(mL) | 滴定结束读数(mL) |
| ① | 25.00 | 0.00 | 10.00 m |
| ② | 25.00 | 1.00 | 11.02 |
| ③ | 25.00 | 0.22 | 12.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.根据物质的元素组成,将纯净物分为单质和化合物 |
| B.通过镁、锌、铁分别与稀盐酸反应的实验现象,比较不同金属的活泼性强弱 |
| C.根据铁制品表面的锈可用稀盐酸溶解除去的事实,说明铁锈主要成分是酸性氧化物 |
| D.打开盛装浓盐酸的试剂瓶塞,观察现象,了解盐酸的某些物理性质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
| B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
| C | H+浓度相同的盐酸和硫酸分别与等质量的形状相同的锌粒反应 | 反应开始速率相同 |
| D | 在容积可变的密闭容器中发生反应H2(g)+ I2(g)  2HI(g),把容积缩小一倍 2HI(g),把容积缩小一倍 | 反应速率不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用浓氢氧化钠溶液除去氯气中少量的氯化氢 |
| B.加入稀硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在 |
| C.食盐中的碘可以直接用淀粉检验其是否存在 |
| D.用干燥的pH试纸可测得新制氯水的pH=2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.红热的铜丝在氯气中燃烧,产生棕黄色的烟 |
| B.碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫色 |
| C.往溴水中加入碘化钠溶液,溴水变为无色 |
| D.氢气在Cl2中燃烧产生白色的烟 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com